
【题目】下列有关电解质溶液的说法正确的是
A.将0.1 mol·L-1 CH3COOH溶液从20 ℃升温至30 ℃,溶液中c(H+)/c(CH3COOH)减小
B.若NH4Cl溶液与NH4HSO4溶液的pH相等,则c(NH![]() )也相等
)也相等
C.向盐酸中加入氨水至中性,溶液中![]() >1
>1
D.常温下,pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合后,溶液pH<7
【答案】D
【解析】
A.醋酸为弱酸,弱酸的电离为吸热过程,将0.1 mol·L-1CH3COOH溶液从20 ℃升温至30 ℃,促进醋酸的电离,溶液中c(H+)/c(CH3COOH)增大,故A错误;
B.由于NH4HSO4电离时产生H+使溶液呈酸性,NH![]() 的水解被抑制,因此NH4HSO4中NH
的水解被抑制,因此NH4HSO4中NH![]() 的浓度小于NH4Cl,故B错误;
的浓度小于NH4Cl,故B错误;
C.向盐酸中加入氨水至中性,c(H+)=c(OH-),根据电荷守恒,![]() ,即
,即![]() =1,故C错误;
=1,故C错误;
D.常温下,pH=2的醋酸溶液的浓度大于0.01mol/L,pH=12的NaOH溶液的浓度等于0.01mol/L,二者等体积混合后,醋酸剩余,所以溶液的pH<7,故D正确;
故选D。


科目:高中化学 来源: 题型:
【题目】某小组按图1所示的装置探究铁的吸氧腐蚀。
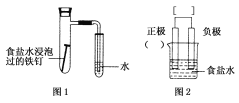
(1)图2是图1所示装置的示意图,在图2的小括号内填写正极材料的化学式_________;在方括号内用箭头表示出电子流动的方向___________。
(2)正极反应式为_____________________,负极反应式为__________________。
(3)按图1装置实验,约8 min时才看到导管中液柱上升,下列措施可以更快更清晰地观察到液柱上升的是________。
a.用纯氧气代替具支试管内的空气
b.将食盐水浸泡过的铁钉表面撒上铁粉和碳粉的混合物
c.用毛细尖嘴管代替玻璃导管,并向试管的水中滴加少量红墨水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)烃是一类重要的有机化合物,其结构与性质密切相关。
①下列有机化合物与甲烷互为同系物的是______(填字母)。
a.乙烯 b.乙烷 c.乙炔
②下列试剂可用于鉴别乙烷和乙烯的是______(填字母)。
a.水 b.四氯化碳 c.酸性KMnO4溶液
③下列有机化合物易溶于水的是________。
a..苯 b.乙烷 c.乙醇
(2) CH2=CH2、![]() 、CH3CH2OH、CH3COOCH2CH3、CH3COOH、葡萄糖,其中:
、CH3CH2OH、CH3COOCH2CH3、CH3COOH、葡萄糖,其中:
①能通过化学反应使溴水褪色的是____________。
②能发生水解反应的是____________。
③能与新制Cu(OH)2悬浊液反应生成砖红色沉淀的是____________。
④能与Na2CO3溶液反应有气体生成的是__________。
(3)以淀粉为主要原料合成一种具有果香味的物质C合成路线如图所示。
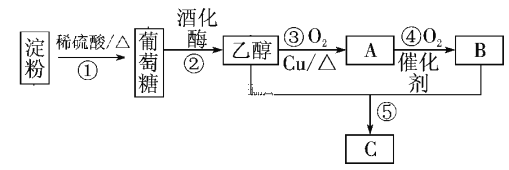
请回答下列问题:
(i) A的结构简式为____________,B分子中的官能团名称为________。
(ii)上述①~⑤的反应中,属于取代反应的有___________。(填序号)
(iii) 写出下列转化的化学方程式:
反应①____________________________;
反应⑤___________________________;
(4)乙烯是石油化工的重要基础原料,工业上可由乙烯与水反应制乙醇,该反应类型为_______,其化学方程式为___________________;乙烯还可通过加聚反应获得高分子材料聚乙烯,化学方程式为____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种可降解聚合物P的合成路线如图:
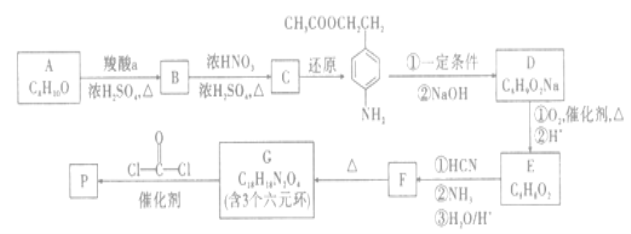
已知:ⅰ.
ⅱ.![]() +2ROH
+2ROH![]() +2HCl(R为烃基)
+2HCl(R为烃基)
回答下列问题:
(1)路线图中C的还原产物的官能团名称是___。
(2)E→F中反应①和②的反应类型分别是__;D→E的第①步化学方程式为__。
(3)F的结构简式为___。
(4)聚合物P的结构简式是___。
(5)A的同分异构体中,含苯环的共有__种。
(6)参照上述合成路线,设计以乙醇为原料,制备C6H10N2O2(含有1个六元环,核磁共振氢谱显示有3组峰,峰面积之比为3:1:1)的合成路线(无机试剂任选)__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于铝及其化合物的说法,不正确的是
A.铝是地壳中含量最多的金属元素,自然界中铝以稳定化合态存在
B.铝制品在空气中有很强的抗腐蚀性是因为铝的化学性质很稳定
C.常温下,铝遇浓硝酸、浓硫酸时会在表面生成致密的氧化物膜而发生钝化
D.向氯化铝溶液中滴加饱和NaF溶液,再滴加氨水,振荡后,没有观察到白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组人员用质量分数为98%,密度为1.84g·cm-3的浓硫酸配制1L2.3mol·L-1的稀硫酸。
(1)所配制的稀硫酸中,H+的物质的量浓度与____mol·L-1的NaHSO4溶液中H+的物质的量浓度相同,NaHSO4与氢氧化钡在溶液中反应使溶液呈中性的离子方程式为_____。
(2)需量取浓硫酸的体积为_____mL。
(3)容量瓶使用前应_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按要求回答下列问题。
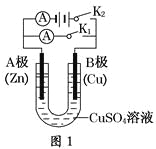
(1)根据图1回答①②:
①若断开K2,闭合K1。
A电极可观察到的现象________________________________________________;
B极的电极反应式为__________________________________________________。
②若断开K1,闭合K2,A电极可观察到的现象是________________;B极的电极反应式为____________。
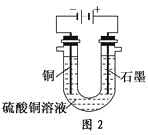
(2)根据图2回答③④:
③将较纯净的CuSO4溶液放入如图所示的装置中进行电解,石墨电极上的电极反应式为________________,电解反应的离子方程式为________________。
④实验完成后,铜电极增重a g,石墨电极产生标准状况下的气体体积________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醛是一种重要的烃类衍生物,广泛应用于纺织、医药、化纤、染料和食品工业。
(一)以乙烯和氧气(或空气)为原料,在由PdCl2、CuCl2、盐酸组成的催化剂水溶液中,进行液相氧化生产乙醛,工业上一般控制反应温度在120~130℃,压强在300~350KPa。又称Wacker法。其反应式为:
主反应:CH2═CH2(g) +![]() O2(g)
O2(g) ![]() CH3CHO(g) ΔH=-243.2 kJ·mol-1
CH3CHO(g) ΔH=-243.2 kJ·mol-1
副反应:![]() CH2═CH2(g) +
CH2═CH2(g) + ![]() O2(g)
O2(g) ![]() CO2(g)+H2O(g) ΔH=-705.5kJ·mol-1
CO2(g)+H2O(g) ΔH=-705.5kJ·mol-1
(1)已知:水的汽化热是44.0 kJ·mol-1,请计算乙烯的燃烧热:ΔH =__________ kJ·mol-1
汽化热:在标准大气压(101KPa)下,使1mol物质在一定温度下蒸发所需要的热量。
(2)Wacker法乙烯氧化制乙醛过程,按照以下机理进行:
①乙烯羰基化反应:_____________________________
②金属钯的再氧化反应:Pd + 2CuCl2 = PdCl2 + 2CuCl
③氯化亚铜的氧化反应:2CuCl + ![]() O2 + 2HCl = 2CuCl2 + H2O
O2 + 2HCl = 2CuCl2 + H2O
请写出①的反应方程式__________________________。
(3)下列有关说法正确的是_______________
A.Wacker法制乙醛反应中,氯化钯是反应催化剂,氯化铜的作用是使催化剂再生,没有氯化铜的存在,就不能完成此催化过程。
B.工业上采用的原料气中乙烯大量过量,并有大量未反应的乙烯气要循环使用,这样可提高乙烯利用率,同时原料气中加入CO2有利于提高乙醛选择性。
C.原料气中乙烯大量过量的原因可能是为了让乙烯的体积分数处在爆炸极限范围之外,以避免危险的发生。
D.乙烯氧化生成乙醛的反应是在气-液相中进行的,加压和升温都有利于提高乙烯和氧在液体中的溶解度,加快反应速率。
(4)控制反应条件在120~130℃和300~350KPa,原料气的体积比是V(C2H4):V(O2):V(CO2):V(N2) = 15:10.5:9.5:65,以一定流速通入催化剂水溶液中,一段时间后反应达平衡,测得乙烯的体积分数是0.1,氧气的体积分数是0.05,如果充入100mol原料气,请计算反应达平衡时,n(CH3CHO) =
___________ mol。(不考虑HCl的挥发)
(二)实际工业生产要求有较高产量,速率不能太低,转化率尽可能大,所以应尽量使平衡正向移动。
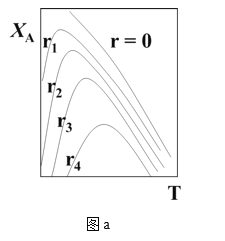
(1)可逆反应:aA+bB![]() rR +s S ,对反应物A,净反应速率为rA = r正(XA) – r逆(XA),XA为反应物A的转化率,图a表示反应物A的转化率和A的净反应速率与温度(T)的关系图。图a分析可知,在相同温度下,净反应速率为________时,XA最大(从“r=0、r1、r2、r3、r4”选填);由图a判断该反应是__________反应(填“吸热”或“放热”),并简述原因__________。
rR +s S ,对反应物A,净反应速率为rA = r正(XA) – r逆(XA),XA为反应物A的转化率,图a表示反应物A的转化率和A的净反应速率与温度(T)的关系图。图a分析可知,在相同温度下,净反应速率为________时,XA最大(从“r=0、r1、r2、r3、r4”选填);由图a判断该反应是__________反应(填“吸热”或“放热”),并简述原因__________。
(2)请在图a中绘制:在不同r下,符合工业生产要求的最佳温度__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z为原子序数依次增大的短周期主族元素,其中Y元素在同周期中离子半径最小;甲、乙分别是元素Y、Z的单质;丙、 丁、戊是由W、X、Y、Z元素组成的二元化合物,常温下丁为液态;戊为酸性气体,常温下0.01 ![]() 戊溶液的pH大于2。上述物质转化关系如图所示。下列说法正确的是( )
戊溶液的pH大于2。上述物质转化关系如图所示。下列说法正确的是( )
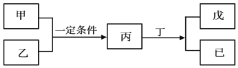
A.原子半径:Z>Y>X>W
B.W和X形成的化合物既可能含有极性键也可能含有非极性键
C.W、X、Y、Z不可能同存于一种离子化合物中
D.比较X、Z非金属性强弱时,可比较其最高价氧化物对应的水化物的酸性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com