

分析 (1)丙醇催化氧化生成丙醛和水;
(2)丙醛催化氧化生成丙酸;
(3)溴乙烷在强碱醇溶液中加热发生消去反应生成乙烯,溴化钠和水;
(4)乙烯水化得到乙醇;
(5)丙酸和乙醇在浓硫酸催化剂作用下加热反应生成丙酸乙酯和水.
解答 解:(1)丙醇催化氧化生成丙醛和水,反应的化学方程式为:2CH3CH2CH2OH+O2$→_{△}^{催化剂}$2CH3CH2CHO+2H2O,
故答案为:2CH3CH2CH2OH+O2$→_{△}^{催化剂}$2CH3CH2CHO+2H2O;
(2)丙醛催化氧化生成丙酸,反应的化学方程式为:2CH3CH2CHO+O2$→_{△}^{催化剂}$2CH3CH2COOH,故答案为:2CH3CH2CHO+O2$→_{△}^{催化剂}$2CH3CH2COOH;
(3)溴乙烷在强碱醇溶液中加热发生消去反应生成乙烯,溴化钠和水,反应的化学方程式为:CH3CH2Br+NaOH$→_{△}^{醇}$CH2=CH2↑+NaBr+H2O,
故答案为:CH3CH2Br+NaOH$→_{△}^{醇}$CH2=CH2↑+NaBr+H2O;
(4)乙烯水化得到乙醇,反应的化学方程式为:CH2=CH2+H2O$→_{△}^{催化剂}$CH3CH2OH,
故答案为:CH2=CH2+H2O$→_{△}^{催化剂}$CH3CH2OH;
(5)丙酸和乙醇在浓硫酸催化剂作用下加热反应生成丙酸乙酯和水,CH3CH2COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3CH2COOCH2CH3+H2O,
故答案为:CH3CH2COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3CH2COOCH2CH3+H2O.
点评 本题考查了有机物性质的分析应用,化学方程式书写,注意反应产物和反应条件的分析应用,掌握基础是解题关键,题目较简单.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 醋酸溶液的pH小于盐酸 | |
| B. | 醋酸的电离方程式:CH3COOH=CH3COO-+H+ | |
| C. | c(CH3COOH)+c(CH3COO-)═c(Cl-) | |
| D. | 0.1mol•L-1 的醋酸溶液与等物质的量浓度、等体积的氢氧化钠溶液混合后:c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
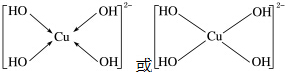 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 “诺龙”属于国际奥委会明确规定的违禁药品中合成代谢类的类固醇,其结构简式如图所示.下列关于“诺龙”的说法中错误的是( )
“诺龙”属于国际奥委会明确规定的违禁药品中合成代谢类的类固醇,其结构简式如图所示.下列关于“诺龙”的说法中错误的是( )| A. | 分子式是C18H26O2 | |
| B. | 能发生银镜反应 | |
| C. | 既能发生加成反应,也能发生酯化反应 | |
| D. | 既能发生氧化反应,也能发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3溶液中和盐酸:CO${\;}_{{3}_{\;}}$2-+2H+=H2O+CO2↑ | |
| B. | 用稀硝酸洗涤试管内壁的银镜:Ag+2H++NO3-=Ag++NO↑+H2O | |
| C. | 向碳酸氢铵溶液中加过量的NaOH溶液并加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| D. | 用MnS除去MnCl2溶液中的Cu2+:MnS+Cu2+=CuS+Mn2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 溶液的导电性 | B. | c(H+) | C. | ka(CH3COOH) | D. | $\frac{c(H{\;}^{+})}{c(CH{\;}_{3}COOH)}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c mol/L | B. | 3c mol/L | C. | $\frac{3c{V}_{1}}{{V}_{2}}$mol/L | D. | $\frac{c{V}_{1}}{{V}_{2}}$mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com