
”¾ĢāÄæ”æÉčNAĪŖ°¢·üŁ¤µĀĀŽ³£ŹżµÄÖµ£¬ĻĀĮŠŠšŹöÕżČ·µÄŹĒ£Ø £©
A. ±ź×¼×“æöĻĀ£¬33.6LSO3ÖŠŗ¬ÓŠĮņŌ×ӵďżÄæĪŖ1.5NA
B. ³£ĪĀ³£Ń¹ĻĀ£¬7.0gŅŅĻ©Óė±ūĻ©µÄ»ģŗĻĪļÖŠŗ¬ÓŠĒāŌ×ӵďżÄæĪŖNA
C. 50mL£¬18.4mol/LÅØĮņĖįÓė×ćĮæĶ³ä·Ö·“Ó¦£¬Éś³ÉSO2·Ö×ӵďżÄæĪŖ0.46NA
D. ijĆܱÕČŻĘ÷Ź¢ÓŠ1molO2ŗĶ2molSO2£¬ŌŚŅ»¶ØĢõ¼žĻĀ³ä·Ö·“Ó¦£¬×ŖŅʵē×ӵďżÄæĪŖ4NA
”¾“š°ø”æB
”¾½āĪö”æ±ź×¼×“æöĻĀ£¬SO3²»ŹĒĘųĢ壬¹ŹA“ķĪó£»ŅŅĻ©Óė±ūĻ©µÄ×ī¼ņŹ½ĪŖCH2£¬ĖłŅŌ7.0gŅŅĻ©Óė±ūĻ©µÄ»ģŗĻĪļÖŠŗ¬ÓŠĒāŌ×ÓµÄĪļÖŹµÄĮæĪŖ![]() ”Į2=1 mol£¬¹ŹBÕżČ·£»Ļ”ĮņĖįÓėĶ²»·“Ó¦£¬50mL£¬18.4mol/LÅØĮņĖįÓė×ćĮæĶ³ä·Ö·“Ó¦£¬Éś³ÉSO2·Ö×ӵďżÄæŠ”ÓŚ0.46NA£¬¹ŹC“ķĪ󣻶žŃõ»ÆĮņÓėŃõĘųÉś³ÉČżŃõ»ÆĮņµÄ·“Ó¦æÉÄę£¬1molO2ŗĶ2molSO2£¬ŌŚŅ»¶ØĢõ¼žĻĀ³ä·Ö·“Ó¦£¬×ŖŅʵē×ӵďżÄæŠ”ÓŚ4NA£¬¹ŹD“ķĪó”£
”Į2=1 mol£¬¹ŹBÕżČ·£»Ļ”ĮņĖįÓėĶ²»·“Ó¦£¬50mL£¬18.4mol/LÅØĮņĖįÓė×ćĮæĶ³ä·Ö·“Ó¦£¬Éś³ÉSO2·Ö×ӵďżÄæŠ”ÓŚ0.46NA£¬¹ŹC“ķĪ󣻶žŃõ»ÆĮņÓėŃõĘųÉś³ÉČżŃõ»ÆĮņµÄ·“Ó¦æÉÄę£¬1molO2ŗĶ2molSO2£¬ŌŚŅ»¶ØĢõ¼žĻĀ³ä·Ö·“Ó¦£¬×ŖŅʵē×ӵďżÄæŠ”ÓŚ4NA£¬¹ŹD“ķĪó”£


 ŌĶĮæģ³µĻµĮŠ“š°ø
ŌĶĮæģ³µĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ¹ŲÓŚ·ÖÉ¢ĻµŗĶ½ŗĢåµÄĖµ·ØÕżČ·µÄŹĒ£Ø £©
A.½ŗĢ唢ČÜŅŗ”¢×ĒŅŗ¶¼ŹĒ·ÖÉ¢Ļµ B£®·ÖÉ¢ÖŹĮ£×ӵİė¾¶£ŗ×ĒŅŗ>ČÜŅŗ>½ŗĢå
C£®æɼū¹āĶعżČÜŅŗŹ±£¬²śÉś¶”“ļ¶ūĻÖĻó D£®½ŗĢ嶼²»ĶøĆ÷£¬ĒŅĪČ¶ØŠŌ¼«Ēæ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æijŠ£»ī¶ÆŠ”×éµÄĶ¬Ń§ÄāÓĆŅŅĻ©“߻ƻ¹Ō¶žŃõ»ÆĮņµÄ·½·ØĄ“ÖĘČ”µ„ÖŹĮņ”£
£Ø1£©¼××éĶ¬Ń§ÓĆŅŅ“¼ĶŃĖ®µÄ·“Ó¦Ą“ÖĘČ”“æ¾»µÄŅŅĻ©ĘųĢ壬Ęä·“Ó¦ŌĄķ¼°Öʱø×°ÖĆČēĻĀ£ŗ
Ö÷·“Ó¦:C2H5OH![]() CH2=CH2”ü+H2O
CH2=CH2ӟ+H2O
ø±·“Ó¦:C2H5OH+2H2SO4£ØÅØ) ![]() C+2SO2”ü+5H2O;
C+2SO2ӟ+5H2O;
C+H2SO4£ØÅØ) ![]() CO2”ü+2SO2”ü+2H2O
CO2ӟ+2SO2ӟ+2H2O
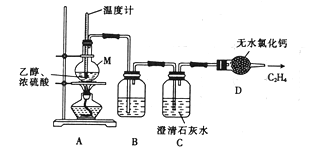
¢Ł ŅĒĘ÷MµÄĆū³ĘŹĒ_______________”£
¢Ś ×°ÖĆB ÖŠŹ¢·ÅµÄŹŌ¼ĮæÉÄÜŹĒ____________”£
¢Ū ×°ÖĆC µÄ×÷ÓĆŹĒ______________
£Ø2£©ŅŅ×éĶ¬Ń§ÓĆ¼××éĶ¬Ń§ÖʵƵÄŅŅĻ©²¢½įŗĻĻĀĮŠ×°ÖĆ½ųŠŠŅŅĻ©“߻ƻ¹Ō¶žŃõ»ÆĮņµÄŹµŃ锣
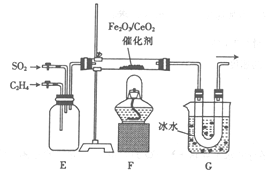
¢Ł ×°ÖĆEµÄ×÷ÓĆŹĒ___________£»×°ÖĆGµÄ×÷ÓĆŹĒ_____________”£
¢Ś ²£Į§¹ÜÖŠÓŠĮņ¼°¶žŃõ»ÆĢ¼Éś³É£¬øĆ·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ_________”£
¢Ū ÓĆĻĀĮŠ×°ÖĆ¼ģŃéGÖŠŅŻ³öµÄĘųĢåŗ¬ÓŠŃõ»Æ²śĪļCO2”£
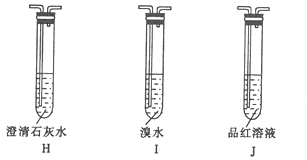
×°ÖĆÕżČ·µÄĮ¬½ÓĖ³ŠņĪŖG![]() _________£¬Ö¤Ć÷GÖŠŅŻ³öµÄĘųĢåŗ¬ÓŠCO2µÄĻÖĻóĪŖ_______”£
_________£¬Ö¤Ć÷GÖŠŅŻ³öµÄĘųĢåŗ¬ÓŠCO2µÄĻÖĻóĪŖ_______”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĪŖĮĖ³żČ„ĮņĖįĶČÜŅŗÖŠŗ¬ÓŠµÄFe2+ŌÓÖŹ£¬ĻČ¼ÓČėŗĻŹŹµÄŃõ»Æ¼ĮŹ¹Fe2+Ńõ»ÆĪŖFe3+ £¬ ĻĀĮŠĪļÖŹÖŠ×īŗĆŃ”ÓĆ£Ø””””£©
A.H2O2ČÜŅŗ
B.KMnO4ČÜŅŗ
C.Cl2Ė®
D.HNO3ČÜŅŗ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÖ»ÓĆĻĀĮŠŹŌ¼ĮÖŠµÄŅ»ÖÖ£¬¾ĶÄܼų±šĒāŃõ»ÆÄĘ”¢ĒāŃõ»ÆøĘŗĶŃĪĖįČżÖÖĪŽÉ«ČÜŅŗ£¬ĖüŹĒ ( )
A£®·ÓĢŖŹŌŅŗ B£®ĀČ»Æ±µČÜŅŗ C£®ŹÆČļŹŌŅŗ D£®Ģ¼ĖįÄĘČÜŅŗ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅŃÖŖĶµÄÅäŗĻĪļA(½į¹¹ČēĶ¼)”£Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©CuµÄ¼ņ»Æµē×ÓÅŲ¼Ź½ĪŖ___________________”£
£Ø2£©AÖŠÅäĪ»Ō×ÓŹĒ_________£¬ÅäĪ»Ō×ӵĵŚŅ»µēĄėÄÜÓɓ󵽊”Ė³ŠņĪŖ_________£¬ŌӻƹģµĄĄąŠĶ¾łĪŖ_______________”£
£Ø3£©ÅäĢå°±»łŅŅĖįøł(H2NCH2COO-)ŹÜČČ·Ö½āæɲśÉśCO2ŗĶN2£¬N2ÖŠ¦Į¼üŗĶ¦Š¼üŹżÄæÖ®±ČŹĒ_________£»N2OÓėCO2»„ĪŖµČµē×ÓĢ壬ĒŅN2O·Ö×ÓÖŠ0Ö»ÓėŅ»øöNĻąĮ¬£¬ŌņN2OµÄµē×ÓŹ½ĪŖ_________”£
£Ø4£©ŌŚCu“ß»ÆĻĀ£¬¼×“¼æɱ»Ńõ»ÆĪŖ¼×Č©(HCHO),¼×Č©·Ö×ÓÖŠH”ŖC”ŖOµÄ¼ü½Ē_________£ØŃ”Ģī”°“óÓŚ”±”¢”°Š”ÓŚ”±»ņ”°µČÓŚ”±£©120”£¼×“¼·Šµć_________¼×Č©£ØŃ”Ģī”°“óÓŚ”±”¢”°Š”ÓŚ”±»ņ”°µČÓŚ”±)£¬ŌŅņŹĒ_________”£
£Ø5£©Į¢·½µŖ»ÆÅšÓė½šøÕŹÆ½į¹¹ĻąĖĘ£¬ŹĒ³¬Ó²²ÄĮĻ”£Į¢·½µŖ»ÆÅšµÄ¾§°ūČēĶ¼ĖłŹ¾£¬NĢī³äŌŚÓÉB×é³ÉµÄĖÄĆęĢåæÕĻ¶ÖŠ£¬ŌņNŌ×Ó°ė¾¶RN×ī“óĪŖ_________(ÓĆBŌ×Ó°ė¾¶RBŗĶ¾§Ģå±ß³¤a±ķŹ¾)£¬Į¢·½µŖ»ÆÅš¾§ĢåÄŚB”ŖN¼üŹżÓėÅšŌ×ÓŹżÖ®±ČĪŖ_________”£½į¹¹»ÆѧÉĻÓĆŌ×Ó×ų±ź²ĪŹż±ķŹ¾¾§°ūÄŚ²æø÷Ō×ÓµÄĻą¶ŌĪ»ÖĆ£¬ĻĀĶ¼£ØÓŅ£©Į¢·½µŖ»ÆÅšµÄ¾§°ūÖŠ£¬BŌ×ÓµÄ×ų±ź²ĪŹż·Ö±šÓŠ£ŗB(0£¬0£¬0)£»B(l/2£¬0£¬l/2)£»B(l/2£¬l/2£¬0)µČ”£Ōņ¾ąĄėÉĻŹöČżøöBŌ×Ó×ī½üĒŅµČ¾ąµÄNŌ×ÓµÄ×ų±ź²ĪŹżĪŖ_________”£

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠĪļÖŹµÄ·Ö×Ó»ņ¾§ĢåÖŠ°üŗ¬ÕżĖÄĆęĢå½į¹¹£¬ĒŅ¼ü½Ē²»µČÓŚ109o28”ÆµÄŹĒ£Ø””””£©
A.°×Į×
B.½šøÕŹÆ
C.°±Ęų
D.¼×Ķé
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŌŚĪŽÉ«µÄĖįŠŌČÜŅŗÖŠæÉŅŌ“óĮæ¹²“ęµÄĄė×Ó×éŹĒ£Ø £©
A.Fe2+ NO3© I© SO42©
B.MnO4© K+ NO3©Na+
C.K+ Al3+ Cl© SO42©
D.Mg2+ SO32© Br© Ba2+
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŌŚ101kPa 25”ꏱ£¬1.0gŅŅĶéĘųĢåĶźČ«Č¼ÉÕÉś³ÉŅŗĢ¬Ė®Ź±·Å³öČČĮæ52.0kJ£¬ŌņŅŅĶéČ¼ÉÕµÄČČ»Æѧ·½³ĢŹ½ĪŖ£Ø””””£©
A. C2H6£Øg£©+![]() O2£Øg£©ØT2CO2£Øg£©+3H2O£Øl£©”÷H=©1560kJmol©1
O2£Øg£©ØT2CO2£Øg£©+3H2O£Øl£©”÷H=©1560kJmol©1
B. 2C2H6£Øg£©+7O2£Øg£©ØT4CO2£Øg£©+6H2O£Øg£©”÷H=©1560kJmol©1
C. 2C2H6£Øg£©+7O2£Øg£©ØT4CO2£Øg£©+6H2O£Øl£©”÷H=+3120 kJmol©1
D. C2H6£Øg£©+![]() O2£Øg£©ØT2CO2£Øg£©+3H2O£Øl£©”÷H=©52.0kJmol©1
O2£Øg£©ØT2CO2£Øg£©+3H2O£Øl£©”÷H=©52.0kJmol©1
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com