
【题目】某化合物AB,A离子核外有10个电子,B离子的L层电子数比其K层与M层电子数之和少2个电子,则AB的化学式为( )
A.NaFB.NaClC.KClD.MgO
科目:高中化学 来源: 题型:
【题目】实验室常用如下装置所示方法制备氯气:
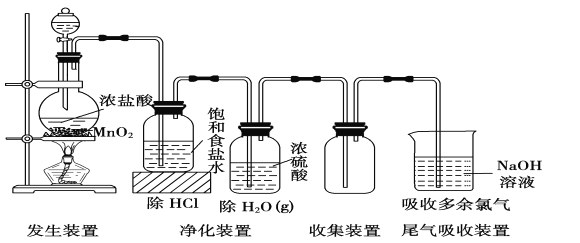
(1)1molMnO2和4mol浓盐酸制得的氯气的产量往往远低于1mol,原因可能是_________________;
(2)若改用NaCl固体、浓硫酸和MnO2一起加热,理论上氯元素利用率可以达到100%,试用化学反应方程式表示原因____________________________________;
(3)若在分液漏斗下方接一段毛细管插入圆底烧瓶底部,不需加热也可获得均匀稳定干燥的氯化氢气流,则分液漏斗和圆底烧瓶中应该盛放的试剂分别是____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白藜芦醇被称之为继紫杉醇之后又一绿色抗癌药物,目前在保健品、食品、化妆品等诸多领域都有了广泛的应用。其合成路线如下:
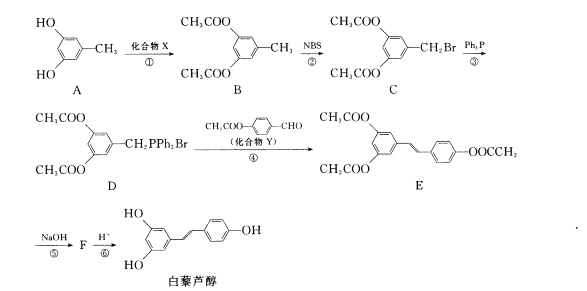
回答下列问题:
(1)物质A中官能团的电子式为____,合成路线中设置反应①的目的是____。
(2)化合物X的蒸气密度是相同条件下H2密度的51倍,则X的结构简式为____。
(3)在反应①~④中属于取代反应的有____。
(4)Y核磁共振氢谱有____组峰,其峰面积之比为____。任写一种与Y核磁共振氢谱峰组数相同、峰面积之比也相同的同分异构体的结构简式____。
(5)反应⑤的化学方程式为____。
(6)白藜芦醇与溴水反应时,1 mol白藜芦醇最多可消耗____mol Br2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素A、B、C都是短周期元素,它们的原子序数大小为A<B<C。A元素原子的最外层电子数为次外层电子数的2倍;B元素原子的次外层电子数是最外层电子数的2倍。B与C可形成共价化合物BC4。请回答下列问题:
(1)这三种元素所对应的气态氢化物中最不稳定的是__________(填化学式),该氢化物在空气中燃烧的化学方程式为__________________________________________________________。
(2)它们的最高价氧化物对应的水化物中酸性最强的是__________,最弱的是__________(填酸的化学式)。
(3)BC4的化学式是__________。BC4不稳定,遇水易形成B的含氧酸及C的氢化物。近代海战中为了掩蔽军事目标,通常采用喷BC4和液氨的方法以形成烟幕,有关化学反应用方程式表示为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某离子晶体晶胞的结构如图所示。X(●)位于立方体顶点,Y(○)位于立方体中心。试

(1)晶体中每个Y同时吸引着__个X,每个X同时吸引着__个Y,该晶体的化学式为____________。
(2)晶体中每个X周围与它最接近且距离相等的X共有___个。
(3)晶体中距离最近的2个X与1个Y形成的夹角∠XYX是____。
(4)设该晶体的摩尔质量为Mg·mol-1,晶体密度为ρg·cm-3,阿伏加德罗常数的值为NA,则晶体中两个距离最近的X中心间距为___cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应①CO(g)+CuO(s)![]() CO2(g)+Cu(s)和反应②H2(g)+CuO(s)
CO2(g)+Cu(s)和反应②H2(g)+CuO(s)![]() Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③CO(g)+H2O(g)
Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是( )
CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是( )
A. 反应①的平衡常数K1=c(CO2).c(Cu)/c(CO).c(CuO)
B. 反应③的平衡常数K=K1/K2
C. 对于反应③,恒容时,温度升高,H2浓度减小,则该反应的焓变为正值
D. 对于反应③,恒温恒容下,增大压强,H2浓度一定减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用![]() 表示阿佛加德罗常数,下列说法正确的是( )
表示阿佛加德罗常数,下列说法正确的是( )
A.常温常压下,11.2 L氧气含有的原子数为![]() 个
个
B.标准状况下,0.2 mol ![]() 的体积为4.48 L
的体积为4.48 L
C.2.3 g金属钠变为离子失去电子数为![]() 个
个
D.常温常压下,![]() 个氢分子的质量为2 g
个氢分子的质量为2 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气,反应如下:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O进行此实验,所用仪器如下图:
MnCl2+Cl2↑+2H2O进行此实验,所用仪器如下图:
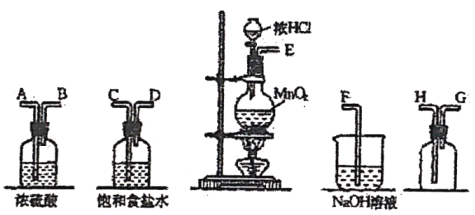
(1)连接上述仪器的正确顺序是(填各接口处的字母):____接______, ____接___, ____接___, ____接___。
(2)在装置中:①饱和食盐水起的作用是___________,②浓硫酸起的作用是____________。
(3)化学实验中检验是否有![]() 产生常用_____试纸,如果有
产生常用_____试纸,如果有![]() 产生,可观察到的现象是_____。
产生,可观察到的现象是_____。
(4)写出F装置中进行的反应的化学方程式:_________。
(5)标准状况下,将4.35克![]() 与含1.55mol HCl的浓盐酸溶液共热(盐酸过量,反应过程中忽略盐酸的挥发)。
与含1.55mol HCl的浓盐酸溶液共热(盐酸过量,反应过程中忽略盐酸的挥发)。
①产生![]() 的体积为___升(标准状况)。
的体积为___升(标准状况)。
②在反应后溶液里加入![]() 溶液,可得AgCl沉淀___克。
溶液,可得AgCl沉淀___克。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定体积的密闭容器中,进行如下化学反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) ,其化学平衡常数K和温度t的关系如下表:
CO2(g)+H2(g) ,其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 850 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应为__________反应(填“吸热”或“放热”).
(2)能判断该反应是否达到化学平衡状态的依据是______________(多选扣分).
A.容器中压强不变 B.混合气体中 c(CO)不变
C.υ正(H2)=υ逆(H2O) D.c(CO2)=c(CO)
(3)850℃ 时,若向一容积可变的密闭容器中同时充入1.0molCO、3.0molH2O、1.0molCO2
和xmolH2,则:
当x=5.0时,上述平衡向____________(填“正反应”、“逆反应”、“恰好平衡”)方向进行.
② 若要使上述反应开始时向正反应方向进行,则x应满足的条件是_________________.
(4)在850℃时,若设x=5.0mol和x=6.0mol,其他物质的投料不变,当上述反应达到平衡后,
测得H2的体积分数分别为a%、b% ,则a _________ b (填“>”、“<”或“=”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com