
| 1.7900g×4 |
| 358g/mol |
| 2.3300g×4 |
| 233g/mol |
| 0.04000mol×2-0.02000mol |
| 3 |
| 9.9800g-0.02000mol×39g/mol-0.04000mol×96g/mol-0.02000mol×52g/mol |
| 18g/mol |


科目:高中化学 来源: 题型:
 某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、HCO3-等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀物质的量随NaOH溶液的体积变化如图所示,下列说法正确的是
某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、HCO3-等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀物质的量随NaOH溶液的体积变化如图所示,下列说法正确的是| A、ab段发生的离子反应为:Al3++3OH-=Al(OH)3↓,Mg2++2OH-=Mg(OH)2↓ |
| B、原溶液中含有的阳离子必定有H+、NH4+、Al3+、Mg2+ |
| C、原溶液中含有的Fe3+和Al3+的物质的量之比为1:1 |
| D、d点溶液中含有的溶质只有NaAlO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
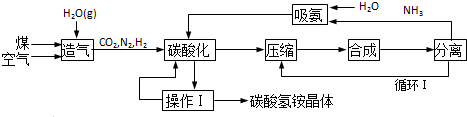
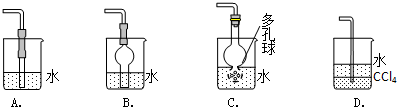
查看答案和解析>>
科目:高中化学 来源: 题型:
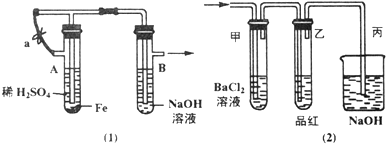
查看答案和解析>>
科目:高中化学 来源: 题型:
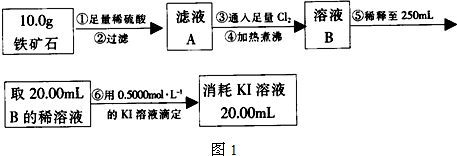
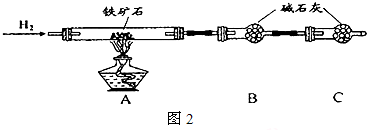

| 棉球 | 棉球上滴加的试剂 | 实验现象 | 解释和结论 |
| a | 棉球变白,微热后又恢复红色 | ||
| b | 含酚酞的NaOH溶液 | 棉球变为白色 | 离子方程式: |
| c | 棉球变为白色 | 结论:该气体具有 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
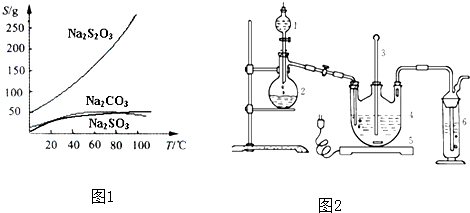
| ||
| 活性炭脱色 |
| 并保温 |
| 操作① |
| 蒸发浓缩 |
| 冷却晶体 |
| 操作② |
| 编号 | 1 | 2 | 3 | 4 |
| 消耗Na2S2O3标准溶液的体积/mL | 18.02 | 17.98 | 18.00 | 20.03 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com