
”¾ĢāÄæ”æijĶ¬Ń§ĄūÓĆČēĻĀŹµŃé×°ÖĆÖʱøÉŁĮæµÄĘÆ°×·Ū”£»Ų“šĻĀĮŠĪŹĢā£ŗ
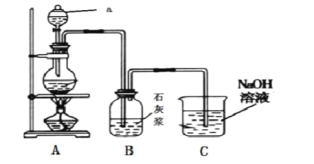
(1)ĘÆ°×·ŪµÄÓŠŠ§³É·ÖŹĒ__________________£ØĢī»ÆѧŹ½£©”£
(2)ŅĒĘ÷aµÄĆū³ĘŹĒ____________£¬ÓƶžŃõ»ÆĆĢŗĶÅØŃĪĖįÖĘČ”ĀČĘųµÄ»Æѧ·½³ĢŹ½ĪŖMnO2 + 4HCl £ØÅØ£©![]() MnCl2 + Cl2 ”ü+ 2H2O øĆ·“Ó¦ÖŠŃõ»Æ¼ĮÓė»¹Ō¼ĮµÄĪļÖŹµÄĮæÖ®±ČĪŖ ________________”£
MnCl2 + Cl2 ”ü+ 2H2O øĆ·“Ó¦ÖŠŃõ»Æ¼ĮÓė»¹Ō¼ĮµÄĪļÖŹµÄĮæÖ®±ČĪŖ ________________”£
(3)×°ÖĆB·¢Éś·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ___________________________________”£
(4)×°ÖĆCµÄ×÷ÓĆŹĒ___________£¬CÖŠ·¢Éś·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ_______________________________”£
”¾“š°ø”æCa(ClO)2 ·ÖŅŗĀ©¶· 1:2 2Ca(OH)2 + 2Cl2 = CaCl2 + Ca(ClO)2 +2H2O ĪüŹÕ¶ąÓąµÄĀČĘų£¬·ĄÖ¹ĪŪČ¾æÕĘų 2OH£ + Cl2 = ClO£ + Cl£ + H2O
”¾½āĪö”æ
(1)ŹÆ»ŅČéÖŠĶØČė![]() ÖʵĆĘÆ°×·Ū£»(2)øł¾Ż×°ÖĆĶ¼·ÖĪöŅĒĘ÷aµÄĆū³Ę£»øł¾Ż»ÆŗĻ¼ŪµÄ±ä»ÆÅŠ¶ĻŃõ»Æ¼Į”¢»¹Ō¼Į£»(3)×°ÖĆBÖŠŹÆ»ŅČéÓėĀČĘų·“Ӧɜ³ÉĀČ»ÆøĘŗĶ“ĪĀČĖįøĘ”¢Ė®£»(4)ĀČĘųÓŠ¶¾£¬ŠčŅŖĪ²Ęų“¦Ąķ£»ĀČĘųÓėĒāŃõ»ÆÄĘ·“Ӧɜ³ÉĀČ»ÆÄĘŗĶ“ĪĀČĖįÄĘ”¢Ė®”£
ÖʵĆĘÆ°×·Ū£»(2)øł¾Ż×°ÖĆĶ¼·ÖĪöŅĒĘ÷aµÄĆū³Ę£»øł¾Ż»ÆŗĻ¼ŪµÄ±ä»ÆÅŠ¶ĻŃõ»Æ¼Į”¢»¹Ō¼Į£»(3)×°ÖĆBÖŠŹÆ»ŅČéÓėĀČĘų·“Ӧɜ³ÉĀČ»ÆøĘŗĶ“ĪĀČĖįøĘ”¢Ė®£»(4)ĀČĘųÓŠ¶¾£¬ŠčŅŖĪ²Ęų“¦Ąķ£»ĀČĘųÓėĒāŃõ»ÆÄĘ·“Ӧɜ³ÉĀČ»ÆÄĘŗĶ“ĪĀČĖįÄĘ”¢Ė®”£
(1)ŹÆ»ŅČéÖŠĶØČė![]() ÖʵĆĘÆ°×·Ū£¬ĘÆ°×·ŪµÄÖ÷ŅŖ³É·ÖŹĒCa(ClO)2”¢CaCl2£¬ÓŠŠ§³É·ÖŹĒCa(ClO)2£»(2)øł¾Ż×°ÖĆĶ¼£¬ŅĒĘ÷aµÄĆū³ĘŹĒ·ÖŅŗĀ©¶·£»øĆ·“Ó¦ÖŠ£¬MnO2 ”śMnCl2£¬MnŌŖĖŲÓÉ+4¼Ū”ś+2¼Ū£¬µĆ2øöµē×Ó£¬ĖłŅŌMnO2ŹĒŃõ»Æ¼Į£» HCl£ØÅØ£©”śCl2£¬ClŌŖĖŲÓÉ-1¼Ū”ś0¼Ū£¬Ź§µē×Ó£¬ĖłŅŌ HClŹĒ»¹Ō¼Į£»HCl”śMnCl2£¬ClŌŖĖŲµÄ»ÆŗĻ¼ŪĆ»±ä»Æ£¬ĖłŅŌHCl×÷Ėį²Ī¼Ó·“Ó¦£¬ĖłŅŌŃõ»Æ¼ĮÓė»¹Ō¼ĮµÄĪļÖŹµÄĮæÖ®±ČŹĒ1£ŗ2£»(3)×°ÖĆBÖŠŹÆ»ŅČéÓėĀČĘų·“Ӧɜ³ÉĀČ»ÆøĘŗĶ“ĪĀČĖįøĘ”¢Ė®£¬·“Ó¦·½³ĢŹ½ŹĒ2Ca(OH)2 + 2Cl2 = CaCl2 + Ca(ClO)2 +2H2O£»(4)ĀČĘųÓŠ¶¾£¬æÉŅŌÓĆĒāŃõ»ÆÄĘČÜŅŗĪüŹÕ£¬×°ÖĆCµÄ×÷ÓĆŹĒĪüŹÕ¶ąÓąµÄĀČĘų£¬·ĄÖ¹ĪŪČ¾æÕĘų£¬CÖŠ·¢Éś·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ2OH£ + Cl2 = ClO£ + Cl£ + H2O”£
ÖʵĆĘÆ°×·Ū£¬ĘÆ°×·ŪµÄÖ÷ŅŖ³É·ÖŹĒCa(ClO)2”¢CaCl2£¬ÓŠŠ§³É·ÖŹĒCa(ClO)2£»(2)øł¾Ż×°ÖĆĶ¼£¬ŅĒĘ÷aµÄĆū³ĘŹĒ·ÖŅŗĀ©¶·£»øĆ·“Ó¦ÖŠ£¬MnO2 ”śMnCl2£¬MnŌŖĖŲÓÉ+4¼Ū”ś+2¼Ū£¬µĆ2øöµē×Ó£¬ĖłŅŌMnO2ŹĒŃõ»Æ¼Į£» HCl£ØÅØ£©”śCl2£¬ClŌŖĖŲÓÉ-1¼Ū”ś0¼Ū£¬Ź§µē×Ó£¬ĖłŅŌ HClŹĒ»¹Ō¼Į£»HCl”śMnCl2£¬ClŌŖĖŲµÄ»ÆŗĻ¼ŪĆ»±ä»Æ£¬ĖłŅŌHCl×÷Ėį²Ī¼Ó·“Ó¦£¬ĖłŅŌŃõ»Æ¼ĮÓė»¹Ō¼ĮµÄĪļÖŹµÄĮæÖ®±ČŹĒ1£ŗ2£»(3)×°ÖĆBÖŠŹÆ»ŅČéÓėĀČĘų·“Ӧɜ³ÉĀČ»ÆøĘŗĶ“ĪĀČĖįøĘ”¢Ė®£¬·“Ó¦·½³ĢŹ½ŹĒ2Ca(OH)2 + 2Cl2 = CaCl2 + Ca(ClO)2 +2H2O£»(4)ĀČĘųÓŠ¶¾£¬æÉŅŌÓĆĒāŃõ»ÆÄĘČÜŅŗĪüŹÕ£¬×°ÖĆCµÄ×÷ÓĆŹĒĪüŹÕ¶ąÓąµÄĀČĘų£¬·ĄÖ¹ĪŪČ¾æÕĘų£¬CÖŠ·¢Éś·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ2OH£ + Cl2 = ClO£ + Cl£ + H2O”£


 ½ņĒŽĢÓż¼ĘĖ抔דŌŖĻµĮŠ“š°ø
½ņĒŽĢÓż¼ĘĖ抔דŌŖĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠÓŠ¹ŲĖµ·ØÖŠÕżČ·µÄŹĒ(””””)
A. Ö÷×åŌŖĖŲµÄµēøŗŠŌŌ½“ó£¬ŌŖĖŲŌ×ӵĵŚŅ»µēĄėÄÜŅ»¶ØŌ½“ó
B. ŌŚŌŖĖŲÖÜĘŚ±ķÖŠ£¬ŌŖĖŲµēøŗŠŌ“Ó×óµ½ÓŅŌ½Ą“Ō½“ó
C. ½šŹōŌŖĖŲµēøŗŠŌŅ»¶ØŠ”ÓŚ·Ē½šŹōŌŖĖŲµēøŗŠŌ
D. ŌŚŠĪ³É»ÆŗĻĪļŹ±£¬µēøŗŠŌŌ½Š”µÄŌŖĖŲŌ½ČŻŅ×ĻŌŹ¾Õż¼Ū
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ·¼Ļć×å»ÆŗĻĪļA(C9H12O)³£ÓĆÓŚŅ©Īļ¼°ĻćĮĻµÄŗĻ³É,AÓŠČēĻĀ×Ŗ»Æ¹ŲĻµ£ŗ
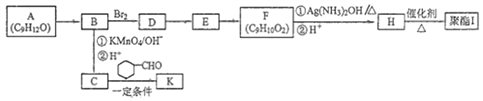
ŅŃÖŖ£ŗ
¢ŁAµÄ±½»·ÉĻÖ»ÓŠŅ»øöÖ§Į“,Ö§Į“ÉĻÓŠĮ½ÖÖ²»Ķ¬»·¾³µÄĒāŌ×Ó
¢Ś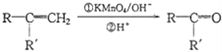 +CO2
+CO2
¢ŪRCOCH3+R'CHO![]() RCOCH=CHR'+H2O
RCOCH=CHR'+H2O
»Ų“šĻĀĮŠĪŹĢā£ŗ
(1)AÉś³ÉBµÄ·“Ó¦ĄąŠĶĪŖ__________,ÓÉDÉś³ÉEµÄ·“Ó¦Ģõ¼žĪŖ_______________”£
(2)HÖŠŗ¬ÓŠµÄ¹ŁÄÜĶÅĆū³ĘĪŖ______________”£
(3)IµÄ½į¹¹¼ņŹ½ĪŖ__________________________”£
(4)ÓÉEÉś³ÉFµÄ»Æѧ·½³ĢŹ½ĪŖ____________________________________________”£
(5)FÓŠ¶ąÖÖĶ¬·ÖŅģ¹¹Ģå,Š“³öŅ»ÖÖ·ūŗĻĻĀĮŠĢõ¼žµÄĶ¬·ÖŅģ¹¹ĢåµÄ½į¹¹¼ņŹ½ĪŖ£ŗ___________________”£
¢ŁÄÜ·¢ÉśĖ®½ā·“Ó¦ŗĶŅų¾µ·“Ó¦
¢ŚŹōÓŚ·¼Ļć×å»ÆŗĻĪļĒŅ·Ö×ÓÖŠÖ»ÓŠŅ»øö¼×»ł
¢Ū¾ßÓŠ5×éŗĖ“Ź²ÕńĒāĘ×·å
(6)æ·²ę±ūĶŖ(![]() )ŹĒŅ»ÖÖÖŲŅŖµÄŅ½Ņ©ÖŠ¼äĢ壬Ēė²Īæ¼ÉĻŹöŗĻ³ÉĀ·Ļߣ¬Éč¼ĘŅ»ĢõÓÉŹå¶”“¼[(CH3)3COH]ŗĶæ·Č©(
)ŹĒŅ»ÖÖÖŲŅŖµÄŅ½Ņ©ÖŠ¼äĢ壬Ēė²Īæ¼ÉĻŹöŗĻ³ÉĀ·Ļߣ¬Éč¼ĘŅ»ĢõÓÉŹå¶”“¼[(CH3)3COH]ŗĶæ·Č©(![]() )ĪŖŌĮĻÖʱøæ·²ę±ūĶŖµÄŗĻ³ÉĀ·Ļß(ĪŽ»śŹŌ¼ĮČĪŃ”£¬ÓĆ½į¹¹¼ņŹ½±ķŹ¾ÓŠ»śĪļ£¬ÓĆ¼żĶ·±ķŹ¾×Ŗ»Æ¹ŲĻµ,¼żĶ·ÉĻ×¢Ć÷ŹŌ¼ĮŗĶ·“Ó¦Ģõ¼ž)£ŗ___________________”£
)ĪŖŌĮĻÖʱøæ·²ę±ūĶŖµÄŗĻ³ÉĀ·Ļß(ĪŽ»śŹŌ¼ĮČĪŃ”£¬ÓĆ½į¹¹¼ņŹ½±ķŹ¾ÓŠ»śĪļ£¬ÓĆ¼żĶ·±ķŹ¾×Ŗ»Æ¹ŲĻµ,¼żĶ·ÉĻ×¢Ć÷ŹŌ¼ĮŗĶ·“Ó¦Ģõ¼ž)£ŗ___________________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĄūÓĆīŃ°×¹¤ŅµµÄø±²śĘ·FeS04[ŗ¬A12(S04)3ŗĶÉŁĮæÖŲ½šŹōĄė×Ó]æÉŅŌÉś²śµē³Ų¼¶øߓ泬Ī¢Ļø²ŻĖįŃĒĢś”£Ę乤ŅÕĮ÷³ĢČēĻĀ£ŗ

ŅŃÖŖ£ŗ
¢Ł5Fe2++MnO4©+8H+ØT5Fe3++Mn2++4H2O
¢Ś5C2O42©+2MnO4©+16H+ØT10CO2”ü+2Mn2++8H2O
(1)³Įµķ¹ż³ĢµÄ·“Ó¦ĪĀ¶ČĪŖ40”ę,ĪĀ¶Č²»ŅĖ¹żøßµÄŌŅņ³żĮĖæŲÖĘ³ĮµķµÄĮ£¾¶Ķā£¬»¹ÓŠ_____”£
(2)ĀĖŅŗ¾“¦ĄķæɵƵ½ø±²śĘ·________£¬æÉ×÷·ŹĮĻ”£
(3)½«Ņ»¶ØĮæøßĆĢĖį¼ŲČÜŅŗÓėĖį»ÆµÄ²ŻĖįŃĒĢśČÜŅŗ»ģŗĻ£¬²āµĆ·“Ó¦ŅŗÖŠMn2+µÄÅضČĖę·“Ó¦Ź±¼ätµÄ±ä»ÆČēĶ¼£¬Ęä±ä»ÆĒ÷ŹĘµÄŌŅņæÉÄÜĪŖ_________”£
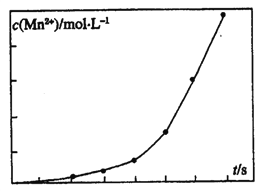
£Ø4£©ŹµŃéŹŅ²ā¶Øøߓ泬Ī¢Ļø²ŻĖįŃĒĢś×é³ÉµÄ²½ÖčŅĄ“ĪĪŖ
²½Öč1:×¼Č·³ĘĮæŅ»¶ØĮæ²ŻĖįŃĒĢśŃłĘ·£¬¼ÓČėµÄH2S04Čܽā”£
²½Öč2:ÓĆ0.200 0molL-1±ź×¼KMn04ČÜŅŗµĪ¶Ø£¬ĻūŗÄĘäĢå»ż30.40 mL”£
²½Öč3£ŗĻņµĪ¶ØŗóµÄČÜŅŗÖŠ¼ÓČė2gZn·ŪŗĶ5mL2molL-1µÄH2S04ČÜŅŗ£¬½«Fe3+»¹ŌĪŖFe2+
²½Öč4:¹żĀĖ£¬ĀĖŅŗÓĆÉĻŹö±ź×¼KMn04ČÜŅŗµĪ¶Ø£¬ĻūŗÄČÜŅŗ10.00 mL.
¼ĘĖćѳʷ֊C2O42-µÄĪļÖŹµÄĮæ_________________”££ØŠ“³ö¼ĘĖć¹ż³Ģ£©
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æČōNA±ķŹ¾°¢·ü¼ÓµĀĀŽ³£Źż£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
A. 2.3gNaŌŚ×ćĮæµÄŃõĘųÖŠ³ä·ÖČ¼ÉÕ£¬×ŖŅʵĵē×ÓŹżĪŖ0.2NA
B. ±ź×¼×“æöĻĀ£¬22.4 LĖ®ÖŠŗ¬ÓŠµÄŃõŌ×ÓŹżĪŖNA
C. 1L 0.5molL©1µÄAlCl3ČÜŅŗÖŠĖłŗ¬ClŹżÄæĪŖ3NA
D. 0.1 mol ĀČĘųĖłŗ¬ÓŠµÄŌ×ÓŹżĪŖ0.2NA
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ25”ꏱ£¬Ksp[Mg(OH)2]£½10£12£¬Ksp(MgF2)£½10£10”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø £©
A. 25”ꏱ£¬ŌŚMg(OH)2µÄŠü×ĒŅŗÖŠ¼ÓČėÉŁĮæµÄNH4Cl¹ĢĢ壬c(Mg2£«)¼õŠ”
B. 25”ꏱ£¬±„ŗĶMg(OH)2ČÜŅŗÓė±„ŗĶMgF2ČÜŅŗĻą±Č£¬Ē°ÕßµÄc(Mg2£«)“ó
C. 25”ꏱ£¬Mg(OH)2¹ĢĢåŌŚ20mL 0.01 molL-1°±Ė®ÖŠµÄKsp±ČŌŚ20mL 0.01 molL-1NH4ClČÜŅŗÖŠµÄKspŠ”
D. 25”ꏱ£¬ÓūÓĆ1L NaFČÜŅŗ½«0.05mol Mg(OH)2ĶźČ«×Ŗ»ÆĪŖMgF2£¬Ōņc(NaF)”Ż1.1 molL-1
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ°Ķ¶¹ĖįµÄ½į¹¹¼ņŹ½ĪŖCH3”ŖCH£½CH”ŖCOOH£¬ĻÖÓŠ¢ŁĖ® ¢ŚĀČ»ÆĒā ¢ŪŅŅ“¼ ¢Ü“æ¼īČÜŅŗ ¢ŻĖįŠŌøßĆĢĖį¼ŲČÜŅŗ£¬ÅŠ¶ĻŌŚŅ»¶ØĢõ¼žĻĀ£¬ÄÜÓė°Ķ¶¹Ėį·“Ó¦µÄĪļÖŹŹĒ
A.Ö»ÓŠ¢Ś¢Ü¢ŻB.Ö»ÓŠ¢Ł¢Ū¢ÜC.Ö»ÓŠ¢Ł¢Ś¢Ü¢ŻD.Č«²æ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŹŅĪĀŹ±£¬ÄūĆŹĖ®ČÜŅŗµÄpHŹĒ3£¬ĘäÖŠµÄc(OH£)ŹĒ
A. 0.1 mol/L B. 1”Į10-3 mol/L C. 1”Į10-7 mol/L D. 1”Į10-11 mol/L
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŗ£Ė®ŹĒŅ»øö¾Ž“óµÄ»Æѧ׏Ō“±¦æā£¬ĄūÓĆŗ£Ė®æÉŅŌ»ńµĆŗܶą»Æ¹¤²śĘ·”£
£Ø1£©ŗ£Ė®ÖŠÖʵƵÄĀČ»ÆÄĘæÉÓĆÓŚÉś²śÉÕ¼ī¼°ĀČĘų”£·“Ó¦µÄĄė×Ó·½³ĢŹ½ŹĒ ”£
£Ø2£©ĄūÓĆÖĘŃĪŗóµÄŃĪĀ±ĢįČ”äåµÄ¹¤ŅÕĮ÷³ĢČēĻĀ(²æ·Ö²Ł×÷ŗĶĢõ¼žŅŃĀŌČ„)£ŗ
![]()
½«Br2ÓėNa2CO3·“Ó¦µÄ»Æѧ·½³ĢŹ½²¹³äĶźÕū£ŗ
![]()
£Ø3£©ŃĪĀ±Õō·¢ĄäČ“ŗóĪö³öĀ±æéµÄÖ÷ŅŖ³É·ÖŹĒMgCl2£¬“ĖĶā»¹ŗ¬Fe2£«”¢Fe3£«”¢Mn2£«µČĄė×Ó”£ŅŌĀ±æéĪŖŌĮĻÖʵĆĆ¾µÄ¹¤ŅÕĮ÷³ĢČēĻĀ(²æ·Ö²Ł×÷ŗĶĢõ¼žŅŃĀŌČ„)£ŗ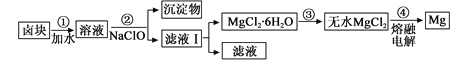
Éś³ÉĒāŃõ»ÆĪļ³ĮµķµÄpH
ĪļÖŹ | æŖŹ¼³Įµķ | ³ĮµķĶźČ« |
Fe(OH)3 | 2£®7 | 3£®7 |
Fe(OH)2 | 7£®6 | 9£®6 |
Mn(OH)2 | 8£®3 | 9£®8 |
Mg(OH) 2 | 9£®6 | 11£®1 |
¢Ł²½Öč¢ŚÖŠŠčæŲÖĘpH=9£®8£¬ĘäÄæµÄŹĒ ”£
¢ŚÓĆNaClO Ńõ»ÆFe2£«µĆµ½Fe(OH)3³ĮµķµÄĄė×Ó·“Ó¦·½³ĢŹ½ŹĒ ”£
¢Ū²½Öč¢ŪŠčŌŚHCl±£»¤ĘųÖŠ¼ÓČČ½ųŠŠ£¬ĒėÓĆ»ÆŃ§Ę½ŗāŅʶÆŌĄķ½āŹĶŌŅņ________”£
¢ÜNaClO»¹ÄܳżČ„ŃĪĀ±ÖŠµÄCO(NH2)2£¬Éś³ÉŃĪŗĶÄܲĪÓė“óĘųŃ»·µÄĪļÖŹ”£³żČ„0£®1mol CO(NH2)2Ź±ĻūŗÄ
NaClO gӣ
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com