
| A、硫酸工业中,增大O2的浓度有利于提高SO2的转化率 |
| B、将FeS固体投入到含有Cu2+的废水中以除去Cu2+ |
| C、选择合适的催化剂可使水在较低温度下分解 |
| D、滴有酚酞的CH3COONa溶液,加热后颜色变深 |
| 催化剂 |
| △ |


科目:高中化学 来源: 题型:
| A、升高温度 |
| B、缩小容器体积 |
| C、增大容器体积 |
| D、降低温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
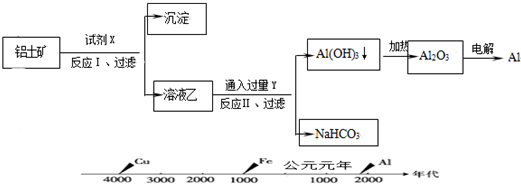
| A、试剂X为稀硫酸 |
| B、反应Ⅱ中生成Al(OH)3的反应为:CO2+2AlO2-+3H2O═2Al(OH)3↓+CO32- |
| C、人类对金属的使用历史与金属活动顺序和冶炼的难易程度有关 |
| D、Al2O3熔点很高,电解耗能大,可采用电解熔融AlCl3冶炼Al |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、增大NO2的浓度,平衡常数增大 |
| B、增大N2O4的浓度,平衡常数增大 |
| C、增大NO2的浓度,正反应速率加快,逆反应速率减慢 |
| D、增大NO2的浓度,平衡常数不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H+,OH-,Na+,SO42- |
| B、Fe3+,Cl-,K+,I- |
| C、Cu2+,NO3-,Na+,Cl- |
| D、Ba2+,Cl-,K+,CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2H2(g)+O2(g)=2H2O(1)△H=-285.8kJ/mol |
| B、2H2(g)+O2(g)=2H2O(1)△H=+571.6 kJ/mol |
| C、2H2(g)+O2(g)=2H2O(g)△H=-571.6 kJ/mol |
| D、H2(g)+O2(g)=H2O(1)△H=-285.8kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com