

| A. | 空气的只要作用是提供氧气作氧化剂 | |
| B. | 电解法中ClO2在阴极发生的电极反应式为:ClO2+Na++e-=NaClO2 | |
| C. | 吸收法中加入H2O2主要是做还原剂 | |
| D. | 从环保的角度考虑,电解法比吸收法更环保 |
分析 A.ClO2气体很不稳定,浓度高时易爆炸,发生器中鼓入空气,可起到稀释浓度的作用;
B.ClO2生成ClO2-,应被还原;
C.ClO2还原为ClO2-,所以过氧化氢是还原剂;
D.电解法中氯离子在阳极失电子生成氯气.
解答 解:A.由信息可知,纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全.发生器中鼓入空气的作用应是稀释ClO2以防止爆炸,所以作用不只是提供氧气作氧化剂,故A错误;
B.ClO2生成ClO2-,应被还原,在阴极生成,电极方程式为ClO2+e-=ClO2-,故B错误;
C.过氧化氢可用作还原剂将ClO2还原为ClO2-,故C正确;
D.电解法中氯离子在阳极失电子生成有毒的氯气,所以从环保的角度考虑,吸收法比电解法更环保,故D错误;
故选C.
点评 本题以学生比较陌生的亚氯酸钠制备为背景,以过氧化氢法制备亚氯酸钠为主线,考查学生阅读题目获取信息的能力、对浓度概念的理解、对氧化还原反应相关知识的运用、有关实验操作和简单实验设计能力考查以及在新情境下综合运用知识解决问题的能力,题目有一定的难度.


科目:高中化学 来源: 题型:多选题
| A. | O2和O3互为同素异形体 | B. | O3是由3个氧原子构成的化合物 | ||
| C. | O2和O3相互转化属于化学变化 | D. | O3的摩尔质量为48g.mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
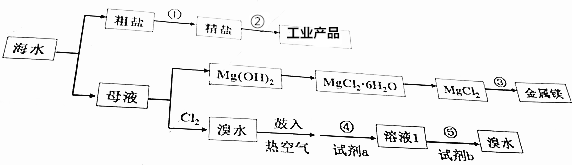
| A. | 步骤①中,除去粗盐中的SO42-、Ca2+、Mg2+等杂质,加入试剂及相关操作顺序可以是:NaO溶液→BaCl2溶液→Na2CO3溶液→过滤→盐酸 | |
| B. | 步骤②的工业产品包括:H2、Cl2、NaOH、Na | |
| C. | 步骤③的方法为点解饱和MgCl2溶液 | |
| D. | 步骤④、⑤中,若试剂a为SO2水溶液,则试剂b可以是Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铁氰化钾{K3[Fe(CN)6]}俗称赤血盐,常用于检验Fe3+,遇Fe2+生成深蓝色沉淀,离子反应方程式为:3Fe2++2[Fe(CN)6]3-═Fe3[Fe(CN)6]2↓.回答下列问题:
铁氰化钾{K3[Fe(CN)6]}俗称赤血盐,常用于检验Fe3+,遇Fe2+生成深蓝色沉淀,离子反应方程式为:3Fe2++2[Fe(CN)6]3-═Fe3[Fe(CN)6]2↓.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | W、X只能形成一种化合物 | B. | 氧化物的水化物的酸性:Y<Z | ||
| C. | 离子半径:Y>Z>X | D. | X与Y不能存在于同一离子化合物中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Z>Y>X | |
| B. | X与R的核电荷数相差8 | |
| C. | 最高价氧化物对应的水化物的酸性:X>R | |
| D. | Y与Z两者最高价氧化物对应的水化物互不反应 |
查看答案和解析>>
科目:高中化学 来源:2017届湖北省荆门市高三上九月联考化学试卷(解析版) 题型:填空题
工业上利用锌焙砂(主要含ZnO、ZnFe2O4,还含有少量FeO、CuO等杂质)制取金属锌的工艺流程如下:回答下列问题:

(1)ZnFe2O4是一种性能优良的软磁材料,也是一种催化剂,能催化烯类有机物氧化脱氢等反应。
① ZnFe2O4中Fe的化合价是___________,从物质分类角度说,ZnFe2O4属于__________(填“酸”、“碱”或“盐”)。
② 工业上利用反应ZnFe2(C2O4)3·6H2O ZnFe2O4+2CO2↑+4CO↑+6H2O制备ZnFe2O4。该反应中氧化产物是_________(填化学式),每生成1mol ZnFe2O4,转移电子的物质的量是___________。
ZnFe2O4+2CO2↑+4CO↑+6H2O制备ZnFe2O4。该反应中氧化产物是_________(填化学式),每生成1mol ZnFe2O4,转移电子的物质的量是___________。
(2)酸浸时要将锌焙砂粉碎,其目的是提高酸浸效率。为达到这一目的,还可采用的措施是___________(任答一条);已知ZnFe2O4能溶于酸,则酸浸后溶液中存在的金属离子有______________。
(3)净化Ⅰ中H2O2参与反应的离子方程式为_______________;试剂X的作用是___________。
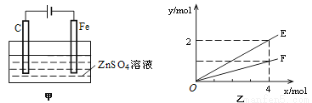
(4)钢铁镀锌是钢铁防护的一种有效方法。按图甲装置进行模拟铁上镀锌的实验,实验结果如图乙所示。乙中横坐标x表示电路中通过电子的物质的量,纵坐标y表示反应物或生成物的物质的量。
① C电极的电极反应式为______________________________。
② E可以表示的量是_________________________(任写一种)。
查看答案和解析>>
科目:高中化学 来源:2017届河南省开封市高三上学期10月定位考试化学试卷(解析版) 题型:选择题
通过以下反应均可获取H2。下列有关说法正确的是
①太阳光催化分解水制氢:2H2O(l) 2H2(g)+O2(g)ΔH1=571.6kJ/mol
2H2(g)+O2(g)ΔH1=571.6kJ/mol
②焦炭与水反应制氢:C(s)+H2O(g) CO(g)+H2(g)ΔH2=131.3kJ/mol
CO(g)+H2(g)ΔH2=131.3kJ/mol
③甲烷与水反应制氢:CH4(g)+H2O(g) CO(g)+3H2(g)ΔH3=206.1kJ/mol
CO(g)+3H2(g)ΔH3=206.1kJ/mol
A.反应①中电能转化为化学能
B.反应②为放热反应
C.反应③使用催化剂,ΔH3减小
D.反应CH4(g) C(s)+2H2(g)的ΔH3=74.8kJ/mol
C(s)+2H2(g)的ΔH3=74.8kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com