
分析 (1)由于不考虑溶液中体积变化和SiO32-水解,则反应后溶液中的氢氧根离子的物质的量等于剩余氢氧化钠的物质的量,结合反应后溶液的pH计算出反应后剩余氢氧化钠的物质的量;
(2)先根据n=cV计算出氢氧化钠的总物质的量,从而可知A中二氧化硅消耗氢氧化钠的物质的量,根据反应SiO2+2NaOH═Na2SiO2+H2O可计算出固体A中二氧化硅的物质的量,最高价m=nM计算出剩余二氧化硅的质量,结合总质量可计算出参加反应Na2CO3+SiO2$\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2↑的SiO2和Na2CO3的总质量,结合反应方程式列式计算出原混合物在加热时发生反应的SiO2和Na2CO3的物质的量,最后可计算出原混合物中SiO2的物质的量分数.
解答 解:(1)不考虑溶液中体积变化和SiO32-水解,测得反应后溶液B中pH=13,说明反应后溶液中c(NaOH)=c(OH-)=0.1mol/L,溶液B中剩余NaOH的物质的量为:0.1mol/L×0.2L=0.02mol,
故答案为:0.02;
(2)200mL 0.2mol•L-1的NaOH溶液中含有氢氧化钠的物质的量为:0.2mol/L×0.2L=0.04mol,则固体A消耗NaOH的物质的量为:0.04mol-0.02mol=0.02mol,则固体A中含有剩余的SiO2,
根据反应SiO2+2NaOH═Na2SiO2+H2O可知,固体A中含有SiO2的物质的量为:0.02mol×$\frac{1}{2}$=0.01mol,质量为:60g/mol×0.01mol=0.6g;
则原混合物中参与反应Na2CO3+SiO2$\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2↑的SiO2和Na2CO3的总质量为:2.26g-0.6g=1.66g,
反应中SiO2和Na2CO3的物质的量相等,设物质的量都为n,则(106g/mol+60g/mol)n=1.66g,解得:n=0.01mol,
所以原混合物中SiO2的物质的量分数为:$\frac{0.01mol+0.01mol}{0.01mol+0.01mol+0.01mol}$×100%=66.7%,
故答案为:66.7%.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应的实质为解答关键,注意掌握溶液pH、物质的量分数的概念及表达式,试题培养了学生的分析能力及化学计算能力.


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 氧化物、氢化物都是只含二种元素 | |
| B. | 混合物中的元素一定是化合态的形式存在 | |
| C. | 金属氧化物一定是碱性氧化物 | |
| D. | 由一种元素组成的物质一定是纯净物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
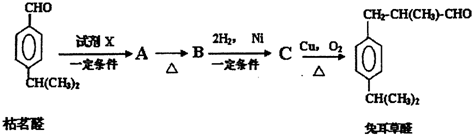

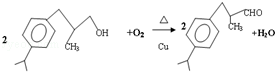 .
. 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④ | B. | ③ | C. | ②③ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
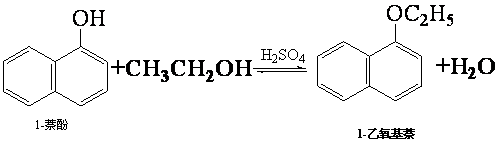
| 物质 | 相对分 子质量 | 状态 | 熔点(℃) | 沸点(℃) | 溶解度 | |
| 水 | 乙醇 | |||||
| 1-萘酚 | 144 | 无色或黄色菱形结晶或粉末 | 96℃ | 278℃ | 微溶于水 | 易溶于乙醇 |
| 1-乙氧基萘 | 172 | 无色液体 | 5.5℃ | 267℃ | 不溶于水 | 易溶于乙醇 |
| 乙醇 | 46 | 无色液体 | -114.1℃ | 78.5℃ | 任意比混溶 | |
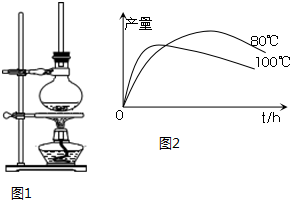
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 | |
| B. | 由C(石墨,s)═C(金刚石,s)△H=+11.9 kJ/mol可知,金刚石比石墨稳定 | |
| C. | 已知在稀溶液中:H+(aq)+OH-(aq)═H2O(l);△H=-57.3 kJ/mol.若将含0.5mol H2SO4的浓硫酸与含1 mol NaOH的稀溶液混合,放出的热量大于57.3 kJ | |
| D. | 甲烷的标准燃烧热为890.3kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2 O2(g)═CO2(g)+2H2O (g)△H=-890.3kJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com