
| A. | pH=0的溶液 | B. | 0.5mol•L-1H2SO4 | ||
| C. | 0.5mol•L-1HCl | D. | 0.5mol•L-1CH3COOH |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
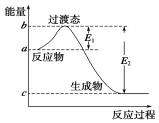 W是由A、B两种元素组成的AB2型化合物.
W是由A、B两种元素组成的AB2型化合物.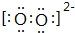 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+ Cl- MnO4- SO42- | B. | Na+ CO32- NO3- SO42- | ||
| C. | Na+ NO3- SO42- HCO3- | D. | Mg2+ SO42- S2- Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

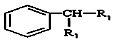 $\stackrel{KMnO_{4}/H+}{→}$
$\stackrel{KMnO_{4}/H+}{→}$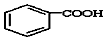
 (-R1、R2表示氢原子或烃基)
(-R1、R2表示氢原子或烃基) ,C的结构简式为CH3CH2OH,
,C的结构简式为CH3CH2OH,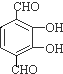 、
、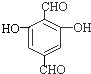 .
. ,反应类型是取代反应.
,反应类型是取代反应.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
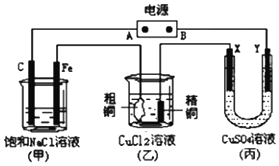 如图所示的装置,X、Y都是惰性电极.将电源接通后,向(甲)中滴入酚酞溶液此空不填,在Fe极附近显红色.丙池中盛有100mL3.00mol•L-1的CuSO4溶液.试回答下列问题:
如图所示的装置,X、Y都是惰性电极.将电源接通后,向(甲)中滴入酚酞溶液此空不填,在Fe极附近显红色.丙池中盛有100mL3.00mol•L-1的CuSO4溶液.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com