
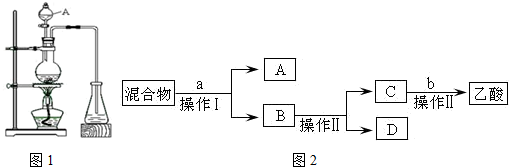
分析 (1)装置图中仪器形状和用途分析可知A为分液漏斗,长导管起导气,冷凝蒸气的作用;
(2)利用乙酸乙酯与水不互溶进行实验设计,反应物乙醇、乙酸及其反应生成的乙酸乙酯的沸点都比较低,通过导气管进入到锥形瓶中,由于乙醇易溶于水,乙酸可以与碳酸钠溶液发生反应,而乙酸乙酯密度比水小,难溶于水,会出现分层现象,所以可以证明锥形瓶中收集到乙酸乙酯的简单方法是加入几滴饱和碳酸钠溶液后震荡弱分层说明乙酸乙酯生成;
(3)锥形瓶中得到的产物是混合物,含有乙酸乙酯、乙醇、乙酸等,加入饱和碳酸钠溶液,分液,A为乙酸乙酯,B含有乙酸钠、乙醇,蒸馏可得乙醇,D为乙醇,C中含有乙酸钠,加入酸可得乙酸;
(4)分析可知化合物加入碳酸钠静置分液得到A为乙酸乙酯,B含有乙酸钠、乙醇,蒸馏可得乙醇;
(5)研究不同催化剂的催化效率,应在相同的温度下进行,因为温度对反应速率有影响.
解答 解:(1)仪器A的名称为:分液漏斗,装置中长导管的主要作用是:长导管起导气,冷凝蒸气的作用,
故答案为:分液漏斗;导气、冷凝产物蒸气;
(2)取适量液体于试管内加入几滴饱和碳酸钠水后溶液振荡,如果不互溶或分层,说明有乙酸乙酯生成,
故答案为:取适量液体于试管内加入几滴饱和碳酸钠水后溶液振荡,如果不互溶或分层,说明有乙酸乙酯生成;
(3)锥形瓶中得到的产物是混合物,含有乙酸乙酯、乙醇、乙酸等,加入饱和碳酸钠溶液,分液,A为乙酸乙酯,B含有乙酸钠、乙醇,蒸馏可得乙醇,D为乙醇,C中含有乙酸钠,加入硫酸可得乙酸,故a为饱和碳酸钠溶液,b试剂为稀硫酸溶液,
故答案为:饱和Na2CO3; 稀硫酸;
(4)由(3)中的工艺流程可知,操作Ⅰ、操作Ⅱ分别是分液、蒸馏,故答案为:C;
(5)研究表明质子酸离子液体也可用作酯化反应的催化剂.通过对比实验可以研究不同催化剂的催化效率,实验中除了需控制反应物乙酸、乙醇的用量相同外,还需控制的实验条件是反应温度或反应时间,
故答案为:温度或反应时间.
点评 本题考查乙酸乙酯的制备、物质的分离提纯等,难度中等,注意基础知识、工艺流程的理解掌握、知识的积累和实验基本操作的理解应用.


 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:高中化学 来源: 题型:填空题
 有a、b两个极易导热的密闭容器,a保持容积不变,b中的活塞可上下移动,以保持内外压强相等.在相同条件下将3molA、1molB分别同时混合于a、b两容器中,发生反应:
有a、b两个极易导热的密闭容器,a保持容积不变,b中的活塞可上下移动,以保持内外压强相等.在相同条件下将3molA、1molB分别同时混合于a、b两容器中,发生反应:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
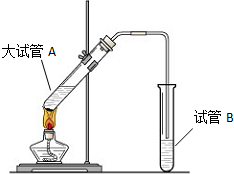 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol CuSO4•5H2O的质量为250g/mol | |
| B. | 125g CuSO4•5H2O的物质的量为0.5 mol | |
| C. | CuSO4•5H2O的摩尔质量为250g | |
| D. | 配制100mL 0.1mol/L 硫酸铜溶液需要CuSO4•5H2O 1.6g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某有机物完全燃烧生成等物质的量的CO2和H2O,该有机物的分子式一定为CnH2n | |
| B. | 异丁烷的一氯代物有2种 | |
| C. | 油脂、乙酸乙酯都属于酯类,但不是同系物 | |
| D. | H2NCH2COOH既可以发生取代反应,也可以发生缩聚反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com