
| ���� | Fe��OH��3 | Fe��OH��2 | Al��OH��3 |
| ��ʼ������pH | 1.9 | 7.0 | 3.4 |
| ��ȫ������pH | 3.2 | 9.0 | 4.7 |
���� ��1��ͬ���壬������������ͬ���������ƣ����ϵ��½�������ǿ��
��2����SrSO4��̼������Һ��Ӧ������ת����ʵ�����ܽ�ƽ����ƶ���������ʯ��ĩ��̼������Һ�Ļ������90��ʱ����1��2h�������ˡ�ϴ�ӣ��õ�̼���ȣ�˵��̼���ȵ��ܽ��С�������ȵ��ܽ�ȣ�
��SrCO3��BaCO3��FeO��Fe2O3��Al2O3�������ᷴӦ��
���ȼ�������ᣬ�����������ӣ����ð�ˮ��pHԼΪ7��ʹ�����ӡ�������ת��Ϊ������
��a���������̿�֪�ù��ղ����ķ�Һ���϶��NH4+��Na+��SO42-��Cl-��
b��������ʯ��ۺ�̼������Һ��Ϻ��ַ�Ӧ��������ӦSrSO4+Na2CO3=SrCO3+Na2SO4���˲��ܳ�ȥ�������裬���������м������������ַ�Ӧ�����ˣ��������費�������������
c������ʱ������������̼����立�Ӧʱ����һ������Ӧ���ɵ�һˮ�ϰ���̼����淋ķ�Ӧ���˷���һ����̼����泥����������Һ����Ӱ�췴Ӧ���̵��ǻ�ϡ��һˮ�ϰ���Ũ�ȣ�ʹ�ø���Ӧ������ռ�ı����Ӷ����٣�Ҳ���������̼����淋������ʣ�
��� �⣺��1��������Sr��Ba������ԣ�Sr��OH��2��Ba��OH��2���ȵĻ�ѧ������ƺͱ����ƣ�����ͬһ����Ԫ�أ�ԭ��������������ͬ��
�ʴ�Ϊ������ͬһ����Ԫ�أ�ԭ��������������ͬ��
��2����I��ֻ��SrSO4��̼������Һ��Ӧ����ӦΪSrSO4+Na2CO3=SrCO3+Na2SO4��ƽ��������У�����̼������Һ��ƽ��������У��ڷ�Ӧ�����в��Ͻ��������߷�Ӧ�����ʺ�Ч��
�ʴ�Ϊ��̼���ȵ��ܽ��С�������ȵ��ܽ�ȣ����裻�ʴ�Ϊ��SrSO4+Na2CO3=SrCO3+Na2SO4�� ����̼������Һ�����裻
�������ʵ��ܽ��Կ�֪��ֻ��̼���κͽ��������������ᷴӦ����SrCO3��BaCO3��FeO��Fe2O3��Al2O3�������ᷴӦ��
�ʴ�Ϊ��SrCO3��BaCO3��FeO��Fe2O3��Al2O3��
���������������������pH��֪������Ŀ���ǽ�Fe2+����ΪFe3+��ʹFe3+��Al3+������ȫ���ʴ�Ϊ����Fe2+����ΪFe3+��ʹFe3+��Al3+������ȫ��
��a���������̿�֪�ù��ղ����ķ�Һ���϶��NH4+��Na+��SO42-��Cl-����a��ȷ��
b��������ʯ��ۺ�̼������Һ��Ϻ��ַ�Ӧ��������ӦSrSO4+Na2CO3=SrCO3+Na2SO4���˲��ܳ�ȥ�������裬���������м������������ַ�Ӧ�����ˣ��������費�������ᣬ���˳�ȥ����b����
c������ʱ������������̼����立�Ӧʱ����һ������Ӧ���ɵ�һˮ�ϰ���̼����淋ķ�Ӧ���˷���һ����̼����泥����������Һ����Ӱ�췴Ӧ���̵��ǻ�ϡ��һˮ�ϰ���Ũ�ȣ�ʹ�ø���Ӧ������ռ�ı����Ӷ����٣�Ҳ���������̼����淋������ʣ���c��ȷ��
�ʴ�Ϊ��ac��
���� ���⿼�����ʵķ����ᴿ������ѡ��Ϊ��Ƶ���㣬�������ʵ����ʼ��Ʊ������еķ�ӦΪ���Ĺؼ���ע�ⷢ���ķ�Ӧ�ķ��������ʵijɷ֣���Ŀ�ѶȽϴ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | N2 | B�� | SO2 | C�� | CO2 | D�� | CO |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ijѧ����0.1000mol•L-1������������Һ�ζ�δ֪Ũ�ȵ�������Һ��������ɷֽ�Ϊ���¼�����
ijѧ����0.1000mol•L-1������������Һ�ζ�δ֪Ũ�ȵ�������Һ��������ɷֽ�Ϊ���¼������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
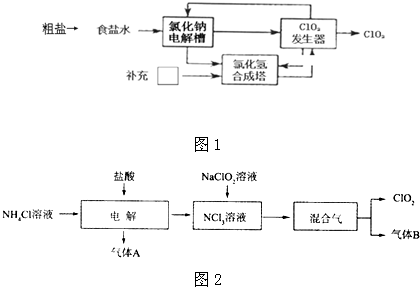
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

| ���� | Cu��OH��2 | Zn��OH��2 | Fe��OH��3 | ZnS | CuS |
| Ksp | 5.0��10-20 | 2.0��10-16 | 4.0��10-16 | 1.2��10-23 | 8.5��10-45 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
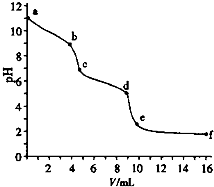 ����֪Ũ�ȵ�����ζ�δ֪Ũ�ȵ�Na2CO3��Һ���� pH��������û����Һ��pH�仯������ͼ����֪������CO2��ҺpHΪ5.6��������˵����ȷ���ǣ�������
����֪Ũ�ȵ�����ζ�δ֪Ũ�ȵ�Na2CO3��Һ���� pH��������û����Һ��pH�仯������ͼ����֪������CO2��ҺpHΪ5.6��������˵����ȷ���ǣ�������| A�� | a�����������ӷ�Ӧ��CO32-+H2O=HCO3-+OH- | |
| B�� | ��pH=6ʱ��c��Na+����c��HCO3-����c��CO32-�� | |
| C�� | ��pH=7ʱ��c��Na+��=c��Cl-�� | |
| D�� | c��d��������Ҫ���ӷ�Ӧ��CO32-+H+=HCO3- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 ���Ȳ�����ˮ��Ҳ������NaHCO3��Һ���ܹ���1mol�û�������Ӧ��H2��HBr����������ֱ��ǣ�������
���Ȳ�����ˮ��Ҳ������NaHCO3��Һ���ܹ���1mol�û�������Ӧ��H2��HBr����������ֱ��ǣ�������| A�� | 1mol�p2mol | B�� | 4mol�p4mol | C�� | 4mol�p2mol | D�� | 4mol�p1mol |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com