
(Ⅰ)常温下,将某一元酸HA(甲、乙、丙、丁代表不同的一元酸)和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如表所示:
| 实验编号 | HA的物质的量浓度(mol/L) | NaOH的物质的量浓度(mol/ L) | 混合后溶液的pH |
| 甲 | 0.1 | 0.1 | pH=a |
| 乙 | 0.12 | 0.1 | pH=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=10 |
(1)从甲组情况分析,如何判断HA是强酸还是弱酸?
________________________________________________________________________。
(2)乙组混合溶液中c(A-)和c(Na+)的大小关系是________。
A.前者大 B.后者大
C.二者相等 D.无法判断
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是________________________________________________________________________。
(4)分析丁组实验数据,写出该混合溶液中下列算式的精确结果(列式):
c(Na+)-c(A-)=________ mol/L。
(Ⅱ)某二元酸(化学式用H2B表示)在水中的电离方程式是:H2B===H++HB- HB-H++B2-
回答下列问题:
(5)在0.1 mol/L的Na2B溶液中,下列粒子浓度关系式正确的是________。
A.c(B2-)+c(HB-)=0.1 mol/L
B.c(B2-)+c(HB-)+c(H2B)=0.1 mol/L
C.c(OH-)=c(H+)+c(HB-)
D.c(Na+)+c(OH-)=c(H+)+c(HB-)
解析:(1)一元酸HA与NaOH等物质的量反应,酸性强弱取决于完全中和后盐溶液的pH,a=7时为强酸,a>7时为弱酸。
(2)据电荷守恒,有c(Na+)+c(H+)=c(A-)+c(OH-),因c(H+)=c(OH-),所以c(Na+)=c(A-)。
(3)丙为等浓度的HA与NaA的混合溶液,由pH>7知A-水解程度大于HA的电离,离子浓度大小关系为c(Na+)>c(A-)>c(OH-)>c(H+)。
(4)据电荷守恒c(Na+)+c(H+)=c(A-)+c(OH-),推导c(Na+)-c(A-)=c(OH-)-c(H+)=10-4-10-10 mol/L。
(5)注意题干中的电离方程式,一级电离为完全电离。判断A项为B元素的物料守恒,C项为溶液中的质子守恒。
答案:(1)a=7时,HA是强酸;a>7时,HA是弱酸
(2)C (3)c(Na+)>c(A-)>c(OH-)>c(H+)
(4)10-4-10-10
(5)AC


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
下表中,对陈述Ⅰ、Ⅱ的正确性及两者间是否具有因果关系的判断都正确的是
| 选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
| A | 碳酸钠溶液可用于治疗胃病 | Na2CO3可与硫酸反应 | Ⅰ对,Ⅱ对,有 |
| B | 将Na2O2加入酚酞试液中,酚酞变红色 | Na2O2与水反应生成氢氧化钠 | Ⅰ对,Ⅱ错,无 |
| C | 金属钠保存在煤油中,以隔绝空气 | 常温下,金属钠在空气中会生成过氧化钠 | Ⅰ对,Ⅱ对,有 |
| D | 过氧化钠可用作航天员的供氧剂 | Na2O2能和CO2、H2O反应生成O2 | Ⅰ对,Ⅱ对,有 |
查看答案和解析>>
科目:高中化学 来源: 题型:
现有浓度均为0.1 mol/L的下列溶液:
①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸铵、⑦硫酸氢铵、⑧氨水,请回答下列问题:
(1)①、②、③、④四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号)______________________。
(2)④、⑤、⑦、⑧四种溶液中NH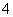 浓度由大到小的顺序是(填序号)________。
浓度由大到小的顺序是(填序号)________。
(3)将③和④等体积混合后,混合液中各离子浓度关系正确的是________。
A.c(Na+)=c(Cl-)>c(OH-)>c(NH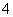 )
)
B.c(Na+)=0.1 mol/L
C.c(Na+)+c(NH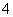 )=c(Cl-)+c(OH-)
)=c(Cl-)+c(OH-)
D.c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,用0.100 0 mol/L NaOH溶液滴定20.00 mL 0.100 0 mol/L CH3COOH溶液所得滴定曲线如图所示。下列说法正确的是( )
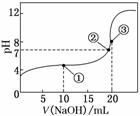
A.点①所示溶液中:
c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+)
B.点②所示溶液中:
c(Na+)=c(CH3COOH)+c(CH3COO-)
C.点③所示溶液中:
c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
D.滴定过程中可能出现:
c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
以下四种有机物的分子式皆为C4H10O:
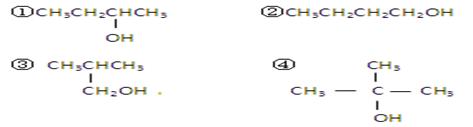
其中既能发生消去反应生成相应的烯烃,又能氧化生成相应醛的是( )
A.①② B.只有② C.②和③ D.③和④
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验方案设计中,可行的是
A.在水中加入氯化铁晶体,加热至沸腾,可得到氢氧化铁胶体
B.氢氧化铁胶体中的H+、Cl-可用过滤的方法除去
C.用蒸发的方法使NaCl从溶液中析出时,将蒸发皿中NaCl溶液全部加热蒸干
D.鉴别氯化铁溶液与氢氧化铁胶体较简便的方法是用激光束照射
查看答案和解析>>
科目:高中化学 来源: 题型:
周期表前四周期的元素a、b、c、d、e,原子序数依次增大。a的核外电子总数与其周期数相同,b的价电子层中未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族;e的最外层只有1个电子,但次外层有18个电子。回答下列问题;
(1)b、c、d中第一电离能最大的是________(填元素符号),e的价层电子轨道示意图为________。
(2)a和其他元素形成的二元共价化合物中,分子呈三角锥形,该分子的中心原子的杂化方式为______;分子中既含有极性共价键、又含有非极性共价键的化合物是________(填化学式,写出两种)。
(3)这些元素形成的含氧酸中,分子的中心原子的价层电子对数为3的酸是________;酸根呈三角锥结构的酸是________。(填化学式)
(4)e和c形成的一种离子化合物的晶体结构如图(a),则e离子的电荷为________。
(5)这5种元素形成的一种1∶1型离子化合物中,阴离子呈四面体结构;阳离子呈轴向狭长的八面体结构[如图(b)所示]。
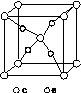
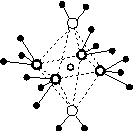
(a) (b)
该化合物中,阴离子为________,阳离子中存在的化学键类型有________;该化合物加热时首先失去的组分是________,判断理由是______________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com