
| A. | 正、逆反应的速率均为零 | B. | 正、逆反应都还在进行 | ||
| C. | 正、逆反应的速率相等 | D. | 反应停止了 |
分析 可逆反应达到平衡状态,正反应速率和逆反应速率相等,各组分的浓度、百分含量不再变化,但是反应没有停止,正逆反应速率不等于0,反应物不可能完全转化成生成物.
解答 解:A、可逆反应达到平衡状态,正逆反应速率相等,正逆反应仍在继续进行,所以正、逆反应速率都不为零,故A错误;
B、可逆反应达到平衡状态,正逆反应速率相等,各组分的浓度不变,但是达到平衡状态,正逆反应仍在继续进行,反应没有停止,故B错误;
C、正、逆反应的速率相等,说明反应达到平衡状态,各组分的浓度不再变化,故C正确;
D、达到了平衡状态,正逆反应仍在继续进行,反应没有停止,故D错误;
故选C.
点评 本题考查化学平衡状态的判断,题目难度不大,注意化学平衡状态的根本标志是:①v(正) =v(逆),②各组分百分含量不变;注意达到平衡状态,正逆反应速率不等于0,反应不会停止,试题培养了学生灵活应用所学知识的能力.


科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ③ | C. | ① | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Na+2H2O=2NaOH+H2↑ | B. | C12+H2O=HC1+HC1O | ||
| C. | 2F2+2H2O=4HF+O2 | D. | 2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
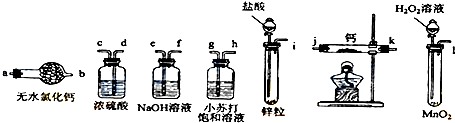
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
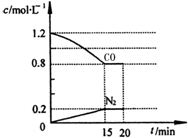 新近出版的《前沿科学》杂志刊发的中国环境科学研究院研究员的论文《汽车尾气污染及其危害》,其中系统地阐述了汽车尾气排放对大气环境及人体健康造成的严重危害.目前降低尾气的可行方法是在汽车排气管上安装催化转化器.NO和CO气体均为汽车尾气的成分,这两种气体在催化转换器中发生反应:2CO(g)+2NO(g)?N2(g)+2CO2(g)△H=-a kJ•mol-1.
新近出版的《前沿科学》杂志刊发的中国环境科学研究院研究员的论文《汽车尾气污染及其危害》,其中系统地阐述了汽车尾气排放对大气环境及人体健康造成的严重危害.目前降低尾气的可行方法是在汽车排气管上安装催化转化器.NO和CO气体均为汽车尾气的成分,这两种气体在催化转换器中发生反应:2CO(g)+2NO(g)?N2(g)+2CO2(g)△H=-a kJ•mol-1.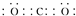 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
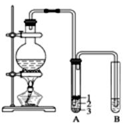 实验室制取少量溴乙烷的装置如图所示.根据题意完成下列填空:
实验室制取少量溴乙烷的装置如图所示.根据题意完成下列填空:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com