
常温下,下列各组离子在指定溶液中一定能大量共存的是 ( )
A.0.1 mol·L-1 NaOH溶液:K+、Na+、SO、CO
B.0.1 mol·L-1 Na2CO3溶液:K+、Ba2+、NO、Cl-
C.0.1 mol·L-1 FeCl3溶液:K+、NH、I-、SCN-
D.c(H+)/c(OH-)=1×1014的溶液:Ca2+、Na+、ClO-、NO
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:
在273 K和101 kPa的条件下,将2.00 g氦气、1.40 g氮气和1.60 g氧气混合,该混合气体的体积是
A.6.72 L B.7.84 L C.10.08 L D.13.44 L
查看答案和解析>>
科目:高中化学 来源: 题型:
采用不同的分类方法,可将非金属氧化物分为不同的类别。例如从某种意义上可将P2O5、SO2、SO3、CO2、Cl2O7等归为一类,则下列氧化物与它们属于同一类的是( )
A.CO B.NO C.Na2O D.N2O5
查看答案和解析>>
科目:高中化学 来源: 题型:
醋酸是一种常见的弱酸,为了证明醋酸是弱电解质,某同学开展了题为“醋酸是弱电解质的实验探究”的探究活动。该同学设计了如下方案,其中错误的是( )
A.先配制一定量的0.10 mol/L CH3COOH溶液,然后测溶液的pH,若pH大于1,则可证明醋酸为弱电解质
B.先配制一定量0.01 mol/L和0.10 mol/L 的CH3COOH溶液,分别用pH计测它们的pH,若两者的pH相差小于1个单位,则可证明醋酸是弱电解质
C.先测0.10 mol/L CH3COOH溶液的pH,然后将其加热至100℃,再测pH,如果pH变小,则可证明醋酸是弱电解质
D.配制一定量的CH3COONa溶液,测其pH,若常温下pH大于7,则可证明醋酸是弱电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
能正确表示下列反应的离子方程式为
A.硫化亚铁溶于稀硝酸中:FeS+2H+=Fe2++H2S
B.NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-=CO+H2O
C.少量SO2通入苯酚钠溶液中:C6H5O-+SO2+H2O=C6H5OH+HSO
D.大理石溶于醋酸中:CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏加德罗常数的值.下列说法正确的是( )
|
| A. | 标准状况下,11.2 L乙烯含有的极性共价键数为NA |
|
| B. | 常温下,5.6 L NO和5.6 L O2的混合气体中含有的分子数为0.5NA |
|
| C. | 16.9 g BaO2固体中阴、阳离子总数为0.2NA |
|
| D. | 含有1 mol Fe(OH)3的氢氧化铁胶体中含有胶粒数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
|
| A. | NaHSO4、Na2O2晶体中的阴、阳离子个数比均为1:2 |
|
| B. | 离子化合物中一定不含共价键 |
|
| C. | 某主族元素的最高价含氧酸为HnROm,则其气态氢化物一般是H2m﹣nR |
|
| D. | 元素周期表中L层电子为奇数的元素所在族序数与该元素原子的L层电子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
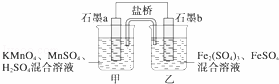
某研究性学习小组根据反应2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计如图原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为1mol•L﹣1,溶液的体积均为200mL,盐桥中装有饱和K2SO4溶液.回答下列问题:
(1)此原电池的正极是石墨 (填“a”或“b”),发生 反应.
(2)电池工作时,盐桥中的SO42﹣移向 (填“甲”或“乙”)烧杯.
(3)两烧杯中的电极反应式分别为
甲 ,
乙 .
(4)若不考虑溶液的体积变化,MnSO4浓度变为1.5mol•L﹣1,则反应中转移的电子为 mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法下列正确的是
A.强电解质的水溶液中不存在溶质分子,弱电解质的水溶液中存在溶质分子和离子
B.强电解质的水溶液导电性强于弱电解质的水溶液
C.强电解质都是离子化合物,弱电解质都是共价化合物
D.强电解质易溶于水,弱电解质难溶于水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com