
分析 苯不与钠反应,生成的氢气为乙醇与水反应生成的,根据氢气的物质的量可以确定混合物中乙醇的量;混合物中氢元素燃烧后都转化成水,根据氢元素质量守恒可以确定苯的物质的量,再根据m=nM计算出苯的质量.
解答 解:标况下11.2L氢气的物质的量为:$\frac{11.2L}{22.4L/mol}$=0.5mol,则混合物中含有C2H5OH的物质的量为:0.5mol×2=1mol,
1mol乙醇完全燃烧会生成水的物质的量为:$\frac{1mol×6}{2}$=3mol,质量为:18g/mol×3mol=54g,
混合物燃烧能生成108g水,则混合物中苯完全燃烧生成水的质量为:108g-54g=54g,水的物质的量为:$\frac{54g}{18g/mol}$=3mol,
3mol水中含有6molH原子,则苯的物质的量为:$\frac{6mol}{6}$=1mol,
所以混合物中苯的质量为:78g/mol×1mol=78g,
答:混合物中苯的质量为78g.
点评 本题考查了混合物反应的计算,题目难度中等,注意掌握质量守恒定律在化学计算中的应用,明确发生反应原理为解答关键,试题培养了学生的化学计算能力.


 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案科目:高中化学 来源: 题型:解答题
 ,
,查看答案和解析>>
科目:高中化学 来源: 题型:解答题

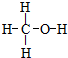 .
.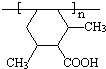 .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.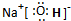 ,这种化合物中所含的化学键类型有离子键、共价键.
,这种化合物中所含的化学键类型有离子键、共价键.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol聚乙烯含有的原子数目为0.6NA | |
| B. | 一定条件下,26 g乙炔、苯和苯乙烯的气态混合物中所含碳原子数为2NA | |
| C. | 1 mol甲基含10 NA个电子 | |
| D. | 标准状况下,22.4L CHCl3中所含有的原子总数为5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K[Ag(CN)2]、[Cu(NH3)4]SO4 | B. | [Ni(NH3)4]Cl2、[Ag(NH3)2]Cl | ||
| C. | [Ag(NH3)2]Cl、[Cu(NH3)2]Cl2 | D. | [Ni(NH3)4]Cl2、[Cu(NH3)4]SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 弱酸 | CH3COOH | HCN | H2CO3 |
| Ka | 1.8×10-8 | 4.9×10-10 | K1;4.3×10-7 K2:5.6×10-11 |
| A. | 等物质的量浓度的各溶液的pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa) | |
| B. | a mol/L HCN与b mol/L NaOH溶液等体积混合后所得溶液中c(Na+)>c(CN-),则a一定小于b | |
| C. | 往冰醋酸中逐滴加水,溶液导电能力先增大,后减小 | |
| D. | NaHCO3和Na2CO3的混合液中:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com