
| A. | 加入催化剂,改变了反应的途径,反应的△H也随之改变 | |
| B. | 反应物总能量小于生成物总能量 | |
| C. | 若在原电池中进行,反应放出的热量不变 | |
| D. | 升高温度,反应速率加快,但反应的△H不变 |
分析 A.催化剂虽然改变了反应途径,但是△H只取决于反应物、生成物的状态;
B.该反应的焓变△H<0,为放热反应;
C.若在原电池中进行,反应将化学能转换为电能;
D.升高温度,化学反应速率加快,但热效应不变.
解答 解:A.催化剂虽然改变了反应途径,反应物、生成物的状态不变,所以其△H不变,故A错误;
B.该反应的△H<0,为放热反应,则反应物总能量高于生成物的总能量,故B错误;
C.若在原电池中进行,反应不放出热量,而是将化学能转换为电能,故C错误;
D.该反应是放热反应,升高温度,化学反应速率加快,但反应的△H不变,故D正确;
故选D.
点评 本题考查了反应热与焓变的应用,题目难度中等,明确化学反应与能量变化的关系为解答关键,A为易错点,注意影响焓变的影响,试题培养了学生的分析能力及灵活应用基础知识的能力.


 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案科目:高中化学 来源: 题型:实验题
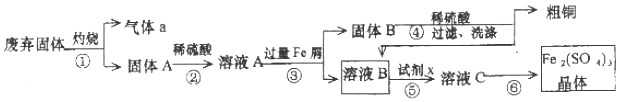
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分离乙酸和乙酸乙酯,常用蒸馏法 | |
| B. | 提纯含有碘的氯化铵,常用升华法 | |
| C. | 除去碳酸钠中的少量碳酸氢钠,常用加热法 | |
| D. | 除去CO2中的SO2,通过盛有溴水的洗气瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
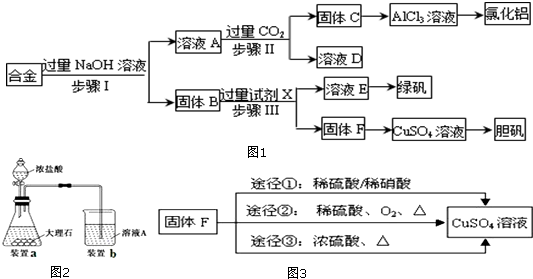
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
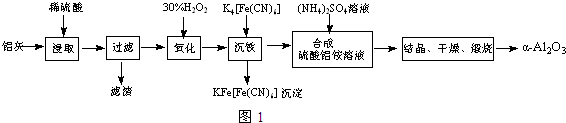
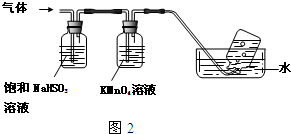 (2)加30%的H2O2溶液的目的是氧化Fe2+为Fe3+,有利于在沉铁过程中除去.
(2)加30%的H2O2溶液的目的是氧化Fe2+为Fe3+,有利于在沉铁过程中除去.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铜是过渡金属元素,可以形成多种化合物.
铜是过渡金属元素,可以形成多种化合物.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③①⑤④ | B. | ①②③⑤④ | C. | ③①②④⑤ | D. | ①⑤②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
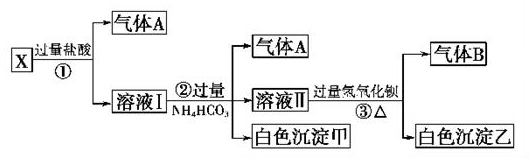
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com