

| c2(NH4HCO3) |
| c[(NH4)2CO3]?c(CO2) |
| c2(NH4HCO3) |
| c[(NH4)2CO3]?c(CO2) |
 ,故答案为:
,故答案为: ;
;

科目:高中化学 来源: 题型:
| A、常温常压下,92g NO2和N2O4的混合气体中含有的原子数与92g NO2所含有的原子数不同 |
| B、同温常压下,相同体积的任何气体中均含有相同的原子数 |
| C、在常温常压下,相同质量的O2和O3具有相同的原子数目 |
| D、1L 1mol/L CH3COONa溶液中含CH3COO-的数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图中,图1为甲烷和O2构成的燃料电池,图2为电解MgCl2溶液的装置.用该装置进行实验,反应开始后,观察到x电极附近出现白色沉淀.下列说法正确的是( )
如图中,图1为甲烷和O2构成的燃料电池,图2为电解MgCl2溶液的装置.用该装置进行实验,反应开始后,观察到x电极附近出现白色沉淀.下列说法正确的是( )| A、A处通入的气体为O2,B处通入的气体为CH4 |
| B、电池内部K+向b极移动,OH-向a极移动 |
| C、图1装置中发生的总反应为CH4+2O2═CO2+2H2O |
| D、图1、图2中电解质溶液的pH均增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定含有甲烷 |
| B、可能有乙烯 |
| C、一定含有乙烷,不一定含有甲烷 |
| D、一定不含有乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、室温下,pH为11的氨水与pH为3的盐酸等体积混合,溶液呈中性 |
| B、在0.1 mol/L(NH4)2Fe(SO4)2溶液中:c(H+)+c(NH4+)+c(Fe2+)═c(OH-)+c(SO42-) |
| C、向醋酸溶液中加入适量醋酸钠,所得酸性溶液中c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| D、0.2mo1?L-1的Na2CO3溶液:c(OH-)═c(HCO3-)+c(H+)+2c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:
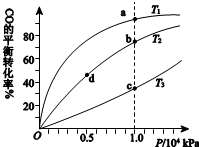 用CO合成甲醇(CH3OH)的化学方程式为CO(g)+2H2(g)?CH3OH(g)△H<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如右下图所示.下列说法正确的是( )
用CO合成甲醇(CH3OH)的化学方程式为CO(g)+2H2(g)?CH3OH(g)△H<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如右下图所示.下列说法正确的是( ) | A.温度: | T1>T2>T3 | |
| B.正反应速率: | υ(b)>υ(d) | υ(a)>υ(c) |
| C.平衡常数: | K(a)>K(c) | K(b)=K(d) |
| D.平均摩尔质量: | M(b)>M(d) | M(a)<M(c) |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com