
| A. | 氢有三种同位素,即有三种氢原子 | |
| B. | 所有元素的原子核均由质子和中子构成 | |
| C. | 具有相同核外电子数的粒子总称为元素 | |
| D. | 相对原子质量相同的原子是同一种元素的原子 |
科目:高中化学 来源: 题型:解答题
| M | N | ||
| X | Y |
 ,(MN)2称为拟卤素,性质与卤素相似,其与氢氧化钠溶液反应的化学方程式为(CN)2+2NaOH=NaCN+NaCNO+H2O,若还原性MN->I-,将适量的(MN)2、I2、KMN、KI在水中混合后,反应的离子方程式为I2+2CN-=2I-+(CN)2.
,(MN)2称为拟卤素,性质与卤素相似,其与氢氧化钠溶液反应的化学方程式为(CN)2+2NaOH=NaCN+NaCNO+H2O,若还原性MN->I-,将适量的(MN)2、I2、KMN、KI在水中混合后,反应的离子方程式为I2+2CN-=2I-+(CN)2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 |
| A | 将钠加入到硫酸铜溶液中 | 有气泡冒出,有红色固体析出 |
| B | 将足量过氧化氢加入到硫酸亚铁溶液中 | 无明显变化 |
| C | 将过氧化钠投入氯化亚铁溶液中 | 最终生成红褐色沉淀 |
| D | 将氢氧化钠溶液逐滴滴入氯化亚铁溶液中 | 立即产生红褐色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
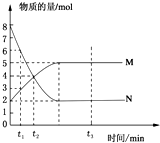 一定温度下,在容积为2L的密闭容器中投入一定量M、N进行反应,M、N的物质的量随时间的变化曲线如图所示:
一定温度下,在容积为2L的密闭容器中投入一定量M、N进行反应,M、N的物质的量随时间的变化曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
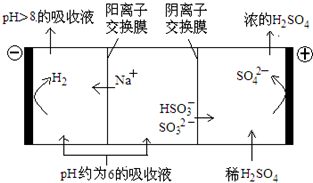
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解质在融化状态下一定导电 | |
| B. | 常温下反应NH3(g)+HCl(g)=NH4Cl(s)能进行,则△H<0 | |
| C. | 常温下等pH的强酸HA和弱酸HB的两种溶液中,是的电离同等程度被抑制 | |
| D. | 恒温密闭容器中充入一定量的A进行反应:3A(g)?B(g)+2C(g),达到平衡后,在其它条件不变情况下,再充入一定量的A气体,A的转化率将不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 验证蔗糖水解产物时,在蔗糖溶液中加几滴稀硫酸,水浴5min,加入新制银氨溶液 | |
| B. | 检验溴乙烷中溴元素时,将溴乙烷和NaOH溶液混合,充分振荡静置后加AgNO3溶液 | |
| C. | 向淀粉溶液中加稀硫酸加热后,加NaOH中和并做银镜反应,检验淀粉是否水解 | |
| D. | 除去苯中混有的少量苯酚,加入浓溴水后过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 钠在空气中燃烧生成的氧化物是Na2O2,则锂在空气中燃烧生成的氧化物是Li2O2 | |
| B. | NH3和PCl3是等电子体,均为三角锥形结构 | |
| C. | CO2和SiO2 化学式相似,则CO2与SiO2的物理性质也相似 | |
| D. | 第二周期元素氢化物稳定性顺序是HF>H2O>NH3;则第三周期元素氢化物稳定性顺序也是HCl>H2S>PH3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com