
【题目】下列离子方程式书写不正确的是
A. 盐酸与Na2SiO3溶液混合: SiO32-+2H+=H2SiO3↓
B. 浓盐酸和二氧化锰共热制取Cl2: MnO2+4H++2Cl- ![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
C. NO2通入水中: H2O+3NO2=2H++2NO3-+NO
D. 向澄清石灰水中通人过量SO2: SO2+Ca2++2OH-=CaSO4↓+H2O
科目:高中化学 来源: 题型:
【题目】已知X是一种黄绿色气体,X、Y、Z都是有刺激性气味的气体,M是一种金属单质,D是一种盐,受热易分解。有以下转化关系,部分产物未标出。
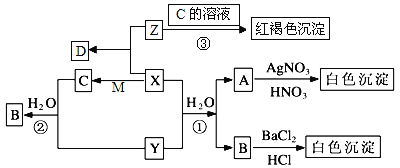
试回答:
(1)写出下列物质的化学式:X________、Y________、M________、D________。
(2)写出下列反应的离子方程式
①_______________________________________,
②_______________________________________,
③_______________________________________。
(3)Z是合成硝酸的重要原料,请写出其与氧气在催化剂的作用下反应的化学方程式___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、W、Z是四种常见的短周期元素,其原子半径随原子序数表化如下图所示.已知X的一种核素的质量数为18,中子数为10,Y和Ne原子的核外电子总数相差1;W的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最强. 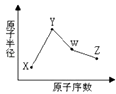
(1)W位于元素周期表中第周期第族.画出X的阴离子的结构示意图 .
(2)Z的氢化物和溴化氢相比,较稳定的是(写化学式);Z的氢化物与氟化氢相比,沸点较高的是(写化学式).
(3)Y的金属性与Mg的金属性相比,(写化学式)的金属性强,请用实验证明它们金属性的相对强弱: .
(4)写出Y的最高价氧化物对应的水化物与Z的最高价氧化物对应的水化物发生反应的化学反应方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】曾因可能致癌而陷舆论风波的除草剂一一草甘膦已于2017 年11月被相关部门正式批准可继续使用,其结构如图所示,下列说法不正确的是

A. 1mol 的草甘膦可以与3mol 的NaOH中和
B. 分子式为C3H8NO5P
C. 可以溶于水
D. 属于酯类的同分异构体只有两种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2005 年,法拉利公司发布的敞篷车(法拉利Superamerica),其玻璃车顶采用了先进的电致变色技术,即在原来玻璃材料基础上增加了有电致变色系统组成五层中膜材料(如下图所示)。其工作原理是: 在外接电源(外加电场) 下,通过在膜材料内部发生氧化还原反应,实现对器件的光透过率进行多级可逆性调节,下列有关说法不正确的是
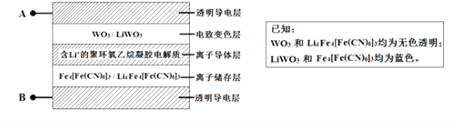
A. 当A接外接电源负极时,电致变色层发生反应为: WO3+Li++e-= LiWO3
B. 当A接外接电源正极时,Li+脱离离子存储层
C. 该电致变色系统在较长时间的使用过程中,离子导体层中Li+的量可保持基本不变
D. 当B接外接电源正极时,膜的透射率降低,可以有效阻挡阳光
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素R、X、Y、Z、T 的原子序数依次增大,由这五种元素组成一种复盐(含2 种阳离子和1种阴离子的盐) M。M 中阳离子和阴离子总数相等。取少量M 溶于水,将所得溶液分成两份:一份滴加氯化钡溶液和盐酸,产生白色沉淀;另一份滴加氢氧化钠溶液,先产生白色沉淀,继续滴加则白色沉淀消失,反应过程中产生有刺激性气味的气体。下列说法正确的是
A. R、X 可以形成X2R4,电子式为![]()
B. 气态氢化物的稳定性: XH3>H2Y>H2T
C. Y 和Z形成的氧化物常作为除去A1Cl3溶液中少量的Fe3+的沉淀剂
D. M 的水溶液中离子浓度大小排序为:c(SO42-) >c(Al3+) > c(NH4+) > c(H+) > c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下将KOH溶液滴加到己二酸(H2X) 溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述正确的是
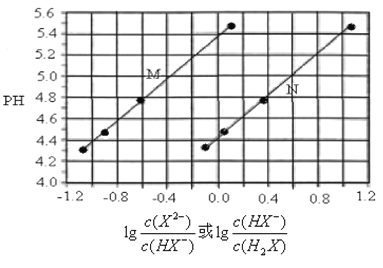
A. Ka2(H2X)的数量级为10–4
B. KHX溶液中c(H+)>c(OH-)
C. 曲线N表示pH与1g[c(X2-)/c(HX-)]的变化关系
D. 当混合溶液呈中性时,c(K+) >c(HX-) > c(X2-) > c(OH-) =c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W是中学常见的四种元素,原子序数依次增大。X的原子最外层电子数是次外层的2倍,Y 的氧化物属于两性氧化物,Y、Z 位于同周期,X、Y、Z的原子最外层电子数之和为14,W是人体必需的微量元素,缺乏W会导致贫血症状。
(1)X在元素周期表中的位置是_________________。
(2)下列事实能用元素周期律解释的是_____________________________________(填字母序号)。
A.Y 的最高价氧化物对应水化物的碱性弱于Mg(OH)2
B.Z的气态氢化物的稳定性小于HF
C.WZ3的溶液可用于刻蚀铜制的印刷电路板
(3)Z的单质可以从NaBr溶液中置换出Br2单质,从原子结构的角度解释其原因是______________________。
(4)工业上用电解法制备Y单质,化学方程式为___________________________。
(5)家用“管道通”的有效成分是烧碱和Y 的单质,使用时需加入一定量的水,此时发生反应的化学方程式为______________________________。
(6)W的单质可用于处理酸性废水中的NO3-,使其转化成为铵根离子,同时生成磁性的W的氧化物H,再进行后续处理。相应离子方程式为____________。Y 的单质与H在高温下反应的化学方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示为元素周期表的一部分,其中X、Y、Z、W为四种短周期元素。Z元素原子核外K层与M层上的电子数相等。下列说法中正确的是( )
![]()
A. Y元素的最高价氧化物对应的水化物的化学式为H3YO4
B. Y的最简单气态氢化物的水溶液显弱碱性
C. 原子半径由小到大的顺序为X<Z<Y<W
D. X、Z两种元素的氧化物中所含化学键的类型相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com