
NA表示阿伏加德罗常数的值,下列叙述正确的是
A.1 L 0.2mol/LCH3COONa溶液中含有0.2NA个CH3COO—
B.标准状况下,11.2LCl2溶于水,转移的电子数为NA
C.常温常压下,23g NO2和N2O4的混合气体含有的原子数为1.5NA
D.100 mL 18.4mol/L浓硫酸与足量铜加热反应,生成SO2的分子数为0.92NA
C
【解析】
试题分析:A.CH3COONa是强碱弱酸盐,在溶液中CH3COO—发生水解反应变为醋酸而消耗,所以1 L 0.2mol/LCH3COONa溶液中含有CH3COO—的个数小于0.2NA个,错误;B.由于氯气溶于水,只有一部分发生反应产生盐酸和次氯酸,Cl2+H2O HCl+HClO,所以标准状况下,11.2LCl2溶于水,转移的电子数远小于0. 5NA,错误;C.常温常压下,23g NO2的物质的量是0. 5mol,含有的原子个数是1.5NA ;23g N2O4的物质的量是0. 25mol,含有的原子个数是1.5NA ;所以23g NO2和N2O4的混合气体含有的原子数为1.5NA,正确;D.浓硫酸能够与Cu在加热时发生反应,随着反应的进行,硫酸变稀,这时反应就不再发生所以100 mL 18.4mol/L浓硫酸与足量铜加热反应,生成SO2的分子数小于0.92NA,错误。
HCl+HClO,所以标准状况下,11.2LCl2溶于水,转移的电子数远小于0. 5NA,错误;C.常温常压下,23g NO2的物质的量是0. 5mol,含有的原子个数是1.5NA ;23g N2O4的物质的量是0. 25mol,含有的原子个数是1.5NA ;所以23g NO2和N2O4的混合气体含有的原子数为1.5NA,正确;D.浓硫酸能够与Cu在加热时发生反应,随着反应的进行,硫酸变稀,这时反应就不再发生所以100 mL 18.4mol/L浓硫酸与足量铜加热反应,生成SO2的分子数小于0.92NA,错误。
考点:考查阿伏加德罗常数的计算的知识。


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源:2014-2015学年宁夏银川市高三上学期第三次月考理综试卷(解析版) 题型:填空题
(14分)铁是应用最广泛的金属,铁的卤化物、氧化物等均为重要化合物。回答下列问题。
(1)FeCl3溶液吸可以吸收烟气中的SO2,该反应的离子方程式是________________。
(2)已知反应:3Br2 + 6FeCl2 = 4FeCl3 + 2FeBr3,向1L 0.4mol/L的FeBr2溶液中通入6.72LCl2(标准状况),写出该反应的离子方程式(用总方程式表示)______________________
(3)已知铁的某种氧化物化学式为FexO(x<1),铁元素的质量分数为76.3%,则FexO中x值(精确至0.01)为 ______,该氧化物中的Fe分别为Fe2+、Fe3+,计算n(Fe2+):n(Fe3+)= _________
(4)用一定量的铁与足量的稀H2SO4及足量的CuO制单质铜,有人设计以下两种方案:
①Fe  H2
H2  Cu,②CuO
Cu,②CuO  CuSO4
CuSO4  Cu。
Cu。
若实验过程中,根据规范的实验方法和实验操作规则进行操作,则两者制得单质铜的量作比较正确的是__________
A.相等 B.①多 C.②多 D.无法判断
(5)在铁与铜的混合物中,加入不足量的稀硝酸,反应后剩余金属m1 g;再向其中加入一定量稀硫酸,充分振荡后,剩余金属m2 g,则m1________(填“大于”、“可能大于”、“等于”或“可能等于”)m2
(6)以铁为阳极,铜为阴极,对足量的NaOH溶液进行电解。一段时间后得到4molFe(OH)3沉淀,此间共消耗的水的物质的量为_______mol
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省德阳市高三一诊考试化学试卷(解析版) 题型:选择题
工业上正在研究利用CO2来生产甲醇燃料,该方法的化学方程式为CO2(g)+3H2(g) CH3OH(g)+H2O(g) ?H=-49.0kJ/mol,一定温度下,在三个容积均为3.0L的恒容密闭容器中发生该反应:
CH3OH(g)+H2O(g) ?H=-49.0kJ/mol,一定温度下,在三个容积均为3.0L的恒容密闭容器中发生该反应:
容器 | 起始物质的量/mol | 平衡物质的量/mol | |||
编号 | 温度/℃ | CO2(g) | H2(g) | CH3OH(g) | H2O(g) |
Ⅰ | T1 | 3 | 4 | 0.5 | 0.5 |
Ⅱ | T1 | 1.5 | 2 | ||
Ⅲ | T2 | 3 | 4 | 0.8 | 0.8 |
下列有关说法不正确的是
A.若经过2min容器I中反应达平衡,则2min内平均速率V(H2)=0.25 mol/(L·min)
B.达到平衡时,容器I中CO2转化率的比容器Ⅱ的大
C.达到平衡时,容器Ⅲ中反应放出的热量比容器Ⅱ的2倍少
D.若容器Ⅰ、Ⅱ、Ⅲ中对应条件下的平衡常数分别为K1、K2、K3,则K1=K2<K3
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省日照市高三12月校际联合检测化学试卷(解析版) 题型:选择题
下列根据实验操作和现象所得出的结论,正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 向某钠盐溶液中滴加稀硫酸 | 产生能够使石灰水变浑浊的气体 | 该溶液中一定含有CO32-或HCO3- |
B | KIO3溶液中加入HI溶液,并加入淀粉 | 溶液变蓝色 | KIO3的氧化性比I2强 |
C | 向Na2S溶液中滴加盐酸 | 产生臭鸡蛋气味的气体 | 氯的非金属性比硫强 |
D | CO还原Fe2O3得到的黑色固体加入盐酸溶解后,再加入KSCN溶液 | 溶液不显红色 | 黑色固体中无Fe3O4 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省日照市高三12月校际联合检测化学试卷(解析版) 题型:选择题
甲、乙是两种常见的化合物,X、Y、Z是三种常见的单质。下表所列各组物质中,物质之间通过一步反应不能实现如图所示转化的是

查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省高密市高三12月检测理综化学试卷(解析版) 题型:填空题
(16分)某工厂对工业生产钛白粉产生的废液进行综合利用,废液中含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4,可用于生产颜料铁红和补血剂乳酸亚铁。其生产工艺流程如下:

已知:
①TiOSO4可溶于水,在水中可以电离为TiO2+和SO42-:
②)TiOSO4水解的反应为:TiOSO4+(x+1)H2O=TiO2?xH2O↓+H2SO4
请回答:
(1)步骤①所得滤渣的主要成分为__________________。
(2)步骤③硫酸亚铁在空气中煅烧生成铁红和三氧化硫,该反应中氧化剂和还原剂的物质的量之比_______。
(3)步骤④需控制反应温度低于35℃,其目的是___________________。
(4)步骤④反应的离子方程式是______________________。
(5)已知:FeCO3(s)  Fe2+(aq)+CO32-(aq),试用平衡移动原理解释步骤⑤生成乳酸亚铁的原因__________。
Fe2+(aq)+CO32-(aq),试用平衡移动原理解释步骤⑤生成乳酸亚铁的原因__________。
(6)溶液B常被用于电解生产(NH4)2S2O8(过二硫酸铵)。电解时均用惰性电极,阳极发生的电极反应可表示为_____________________________________。
(7)Fe3+对H2O2的分解具有催化作用。利用下图(a)和(b)中的信息,按图(c)装置(连通的A、B瓶中已充有NO2气体)进行实验。可观察到B瓶中气体颜色比A瓶中的_________(填“深”或“浅”),其原因是______________。
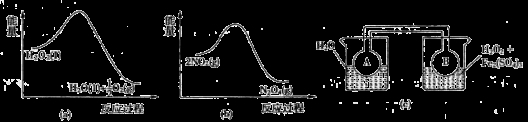
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省高密市高三12月检测理综化学试卷(解析版) 题型:选择题
一元中强酸次磷酸(H3PO2)是一种精细化工产品,下列说法正确的是
A.次磷酸的电离方程式为H3PO2 3H++PO23-
3H++PO23-
B.次磷酸中P的化合价为+1
C.NaH2PO2是酸式盐
D.NaH2PO2溶液显弱酸性
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省英文学校高三上学期12月月考化学试卷(解析版) 题型:选择题
将4 mol金属Al全部转化为Al(OH)3,过程中共消耗HCl a mol、NaOH b mol,则a+b最小值为
A、4 B、6 C、8 D、16
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省高三上学期12月月考化学试卷(解析版) 题型:选择题
设NA表示阿伏加德常数的数值,下列叙述中不正确的是
A.常温常压下,20g D2O和足量的金属钠反应产生气体的分子数为0.5NA
B.常温常压下,32g O2—离子中所含电子的数目为17NA
C.含0.01mol H2O2的水溶液跟MnO2充分作用,反应过程中转移的电子总数0.02NA
D.53g Na2CO3固体含有的离子数为1.5NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com