
A~H均为有机化合物,它们之间的转化关系如图所示
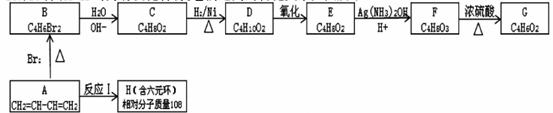
已知:①反应 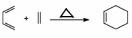
②E既能发生银镜反应,又能与金属钠反应放出氢气。
③核磁共振氢谱表明G分子中有三种氢,且其峰面积之比为1:1:1
(1)A的名称(系统命名法)____________________。
(2)B生成C的反应类型为____________________。
(3)D中含氧官能团的名称为____________________。
(4)由E生成F的第一步反应化学方程式为____________________。与F具有相同官能团的F的同分异构体还有__________种。(填数字)
(5)由A生成H的化学方程式为____________________。
(6)G的结构简式为______________________________。
科目:高中化学 来源: 题型:
难溶化合物的饱和溶液存在着溶解平衡,例如:
AgCl(s) 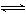 Ag++
Ag++ ,Ag2CrO4(s)
,Ag2CrO4(s) 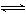 2Ag++
2Ag++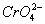 ,在一定温度下,难溶化合物饱和溶液离子浓度的乘积为一常数,这个常数用Ksp表示。
,在一定温度下,难溶化合物饱和溶液离子浓度的乘积为一常数,这个常数用Ksp表示。
已知:Ksp(AgCl)=[Ag+][ ]=1.8×12-12
]=1.8×12-12
Ksp(Ag2CrO4)=[Ag+]2[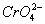 ]=1.9×12-12
]=1.9×12-12
现有0.001摩/升AgNO3溶液滴定0.001摩/升KCl和0.001摩/升的K2CrO4的混和溶液,试通过计算回答:
(1)  和
和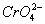 中哪种先沉淀?
中哪种先沉淀?
(2)当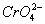 -以Ag2CrO4形式沉淀时,溶液中的
-以Ag2CrO4形式沉淀时,溶液中的 Cl-离子浓度是多少?
Cl-离子浓度是多少? 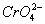 与
与 能否达到有效的分离?(设当一种离子开始沉淀时,另一种离子浓度小于12-5mol/L时,则认为可以达到有效分离)
能否达到有效的分离?(设当一种离子开始沉淀时,另一种离子浓度小于12-5mol/L时,则认为可以达到有效分离)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列措施有利于节能减排、改善环境质量的是
①研制开发新型燃料电池汽车,减少机动车尾气污染 ②开发推广太阳能、水能、风能等能源 ③使用填埋法处理未经分类的生活垃圾 ④推广使用燃煤脱硫技术,防治SO2污染
A.①②④ B.①② C.①②③④ D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
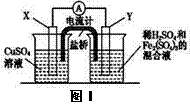 金属铜不溶于稀硫酸,可溶于铁盐溶液生成铜盐与亚铁盐。现将一定量的铜片加入到100 mL稀硫酸和硫酸铁的混合溶液中,铜片完全溶解。
金属铜不溶于稀硫酸,可溶于铁盐溶液生成铜盐与亚铁盐。现将一定量的铜片加入到100 mL稀硫酸和硫酸铁的混合溶液中,铜片完全溶解。
(1)写出铜溶于上述混合溶液的离子方程式 。
(2)若在如图Ⅰ所示的装置中发生(1)中的反应,则X极是
(“正极”或“负极”),电极反应式是
(3)铜完全溶解时,所得溶液中Fe3+、Cu2+、H+三种阳离子的浓
度均为0.2 mol/L(假设溶液体积不变),若用电解方法回收铜,
 装置如图Ⅱ所示。
装置如图Ⅱ所示。
①电解开始阶段,阳极的电极反应式为 ,
阴极的电极反应式为 。
②判断溶液中的Cu2+已完全析出的现象是 。
当Cu2+恰好完全析出时,转移电子的物质的量 。
查看答案和解析>>
科目:高中化学 来源: 题型:
利用表中实验器材(规格和数量不限),能完成相应实验的一项是( )
| 选项 | 实验器材(省略夹持装置) | 相应实验 |
| A | 烧杯、玻璃棒、胶头滴管、分液漏斗 | 用溴水和苯除去 |
| B | 烧杯、玻璃棒、胶头滴管、滤纸 | 用盐酸除去硫酸钡中的少量碳酸钡 |
| C | 烧杯、玻璃棒、胶头滴管、容量瓶 | 用固体碳酸钠配制 |
| D | 烧杯、玻璃棒、胶头滴管、酒精灯 | 硫酸铜溶液的浓缩结晶 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ。且氧气中1 mol O=O键完全断裂时吸收热量496 kJ,水蒸气中1 mol H-O键形成时放出热量463 kJ,则氢气中1mol H-H键断裂时吸收热量为( )
A.920 kJ B.557 kJ C.436 kJ D.188 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
在100 mL H2SO4和CuSO4的混合液中,用石墨作电极电解,两极上均收集到2.24 L气体(标准状况下),则原混合液中,Cu2+的物质的量浓度为( )
A.1 mol·L-1 B.2 mol·L-1 C.3 mol·L-1 D.4 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室中有6瓶失去标签的白色固体:纯碱、氢氧化镁、氯化钡、硫酸铝、硫酸氢钠、氯化钾。除蒸馏水、试管和胶头滴管外,无其他任何试剂和仪器。某学生通过以下实验步骤即可鉴别它们。请填写下列空白:
(1)各取适量固体于6支试管中,分别加入适量蒸馏水,有一支试管中的现象和其他5支明显不同,此试管中的现象是______________________________________________,
据此现象鉴别出的一种物质是__________。
(2)分别将所剩5种溶液依次编号为A、B、C、D、E,然后进行两两混合。观 察到C没有出现任何现象;D分别和A、B、E混合时均产生了白色沉淀;B和E混合时既有白色沉淀产生,又有无色气体放出。据此可推断出:
察到C没有出现任何现象;D分别和A、B、E混合时均产生了白色沉淀;B和E混合时既有白色沉淀产生,又有无色气体放出。据此可推断出:
①A、C、D三种物质的化学式依次是_______________________________________。
②B、E两者中有一种可与A反应,它与足量A反应的离子方程式为________ ____。
____。
③在两两混合时,能最终确定B、E成分的实验现象及结论是_____________________。
(3)上述物质溶于水抑制水的电离,且溶液显酸性的物质的化学式为________,其溶液显酸性的原因是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
一个完整的氧化还原反应方程式可以拆开,写成两个“半反应式”,一个是“氧化反应式”,一个是“还原反应式”。如2Fe3++Cu===2Fe2++Cu2+,可拆写为氧化反应式:Cu-2e-===Cu2+,还原反应式:2Fe3++2e-=== 2Fe2+。据此,回答下列问题:
⑴将反应Zn+2H+ === Zn2++H2↑拆写为两个“半反应式”:
氧化反应式: ,还原反应式: 。
⑵将反应3NO2+H2O == 2H++2NO3—+NO拆写为两个“半反应式”:
氧化反应式: ,还原反应式: 。
⑶已知某反应的两个“半反应式”为:CH4+12 OH--8e-===CO32-+7H2O,O2+2H2O+4e-=== 4OH—,则氧化还原反应方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com