
| 编号 | 金属(粉末状)(mol) | 酸的浓度及体积 | 反应温度(℃) | ||
| A | Al | 0.1 | 0.1mol•L-1 硫酸 | 10mL | 60 |
| B | Fe | 0.1 | 0.2mol•L-1盐酸 | 10mL | 60 |
| C | Al | 0.1 | 18mol•L-1 硫酸 | 10mL | 60 |
| D | Mg | 0.1 | 0.2mol•L-1 硝酸 | 10mL | 60 |
| A. | A | B. | B | C. | C | D. | D |
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L 0.1mol•L-1的纯碱溶液中含有0.1NA个Na+ | |
| B. | 常温常压下,23g NO2中含有NA个氧原子 | |
| C. | 常温常压下,22.4L CCl4含有个NACCl4分子 | |
| D. | 1molFe与足量的盐酸反应,转移3NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用石灰对煤燃烧后形成的烟气脱硫,并回收石膏符合节能减排的理念 | |
| B. | 自发反应也可能是熵减小的反应 | |
| C. | 二次电池放电过程中的反应属于自发反应 | |
| D. | 若C2H2的燃烧热为1300 kJ•mol-1,在其燃烧过程中每转移5NA个电子会放出1300 kJ的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.03mol•L-1的蔗糖溶液 | B. | 0.03mol•L-1的BaCl2溶液 | ||
| C. | 0.04mol•L-1的NaCl溶液 | D. | 0.02mol•L-1的CH3COOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用催化剂能够降低化学反应的反应热△H | |
| B. | HCl和NaOH反应的中和热△H=-57.3 kJ/mol,则H2SO4和NH3•H2O反应的中和热△H=2×(-57.3)kJ/mol | |
| C. | 需要加热才能发生的反应一定是吸热反应 | |
| D. | CO(g)的燃烧热是283.0 kJ/mol,则2CO2(g)=2CO(g)+O2(g)的△H=+2×283.0 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
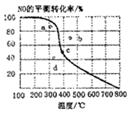 如图中曲线为一定压强下NO的平衡转化率与温度的关系,图中a、b、c、d四点表示不同温度、压强下2NO(g)+O2(g)?2NO2(g)达到平衡时NO的转化率,则压强最大的点为( )
如图中曲线为一定压强下NO的平衡转化率与温度的关系,图中a、b、c、d四点表示不同温度、压强下2NO(g)+O2(g)?2NO2(g)达到平衡时NO的转化率,则压强最大的点为( )| A. | a | B. | b | C. | c | D. | d |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com