
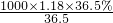 mol/L=11.8mol/L,
mol/L=11.8mol/L, ×2.95mol/L=1.475mol/L,
×2.95mol/L=1.475mol/L,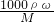 计算该浓盐酸的物质的量浓度;
计算该浓盐酸的物质的量浓度;

 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2011-2012学年安徽省副林中学高一上学期期中考试化学试卷(带解析) 题型:计算题
现有50mL密度为1.18g/mL、质量分数为36.5%的浓盐酸:求
(1)此浓盐酸的物质的量浓度
(2)将此浓盐酸用蒸馏水稀释至200mL,则稀释后盐酸的物质的量浓度为多少?
查看答案和解析>>
科目:高中化学 来源:2012-2013学年广东省揭阳一中南区学校高一上学期期中考试化学试卷(带解析) 题型:计算题
(4分)现有50mL密度为1.18g/mL、质量分数为36.5%的浓盐酸:求
(1)此浓盐酸的物质的量浓度为_________
(2)将此浓盐酸用蒸馏水稀释至200mL,则稀释后溶液中Cl-的物质的量浓度与______ mol/L的氯化镁溶液中的Cl-浓度相同。
查看答案和解析>>
科目:高中化学 来源:2014届安徽省高一上学期期中考试化学试卷(解析版) 题型:计算题
现有50mL密度为1.18g/mL、质量分数为36.5%的浓盐酸:求
(1)此浓盐酸的物质的量浓度
(2)将此浓盐酸用蒸馏水稀释至200mL,则稀释后盐酸的物质的量浓度为多少?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com