
分析 (1)根据公式c=$\frac{n}{V}$计算物质的量浓度;
(2)向此Na2CO3溶液滴加足量盐酸溶液,产生二氧化碳、氯化钠和水,根据碳元素守恒来计算;
(3)根据公式V=nVm来计算气体的体积.
解答 解:(1)把10.6g Na2CO3溶于水,配成2L溶液,那么Na2CO3物质的量浓度c=$\frac{\frac{10.6g}{106g/mol}}{2L}$=0.05mol/L,答:Na2CO3物质的量浓度是0.05mol/L;
(2)向此Na2CO3溶液滴加足量盐酸溶液,能生成CO2的物质的量和碳酸钠的物质的量是相等的,都是0.1mol,所以产生二氧化碳的质量m=0.1mol×44g/mol=4.4g,答:能生成4.4克CO2气体;
(3)生成的CO2气体在标准状况下体积为V=nVm=0.1mol×22.4L/mol=2.24L,答:生成的CO2气体在标准状况下体积为2.24L.
点评 本题考查学生化学方程式中物质的量的有关计算知识,注意知识的迁移应用是关键,难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | ①中X2+是氧化产物 | B. | 还原性强弱的顺序为:Z->A2+ | ||
| C. | 氧化性强弱的顺序为:XO4->B2 | D. | 溶液中可发生:Z2+2A2+=2A3++2Z- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
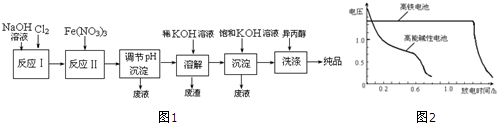
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com