
| A、燃料电池由外设装备提供燃料和氧化剂 |
| B、Mg和Al通常用热还原的方法来冶炼 |
| C、绿色化学的核心是应用化学原理对环境污染进行治理 |
| D、蛋白质、棉花、淀粉、油脂都是由高分子组成的物质 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| 物质 | H2 | CO | CH3OH |
| 浓度(mol/L) | 0.2 | 0.1 | 0.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Y元素位于第二周期第ⅦA族或0族 |
| B、X、Y、Z三种元素中非金属性最强的是X元素 |
| C、X、Y、Z三种元素形成的简单离子的半径都比Mg2+半径小 |
| D、Z分别与X、Y形成的化合物都是离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
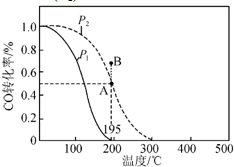 在20L的密闭容器中按物质的量之比1:2充入CO和H2,发生:CO(g)+2H2(g)?CH3OH(g);△H.测得CO的转化率随温度及不同压强下CO的变化如图所示,P2和195℃时n(H2)随时间的变化结果如表所示.下列说法正确的是( )
在20L的密闭容器中按物质的量之比1:2充入CO和H2,发生:CO(g)+2H2(g)?CH3OH(g);△H.测得CO的转化率随温度及不同压强下CO的变化如图所示,P2和195℃时n(H2)随时间的变化结果如表所示.下列说法正确的是( )| t/min | 0 | 1 | 3 | 5 |
| n(H2)/mol | 8 | 5 | 4 | 4 |
| A、P1<P2,△H<0 |
| B、0~3 min,平均速率v(CH3OH)=0.8 mol?L-1?min-1 |
| C、在P2及195℃时,该反应的平衡常数为25 L2?mol-2 |
| D、在B点时,v(正)>v(逆) |
查看答案和解析>>
科目:高中化学 来源: 题型:
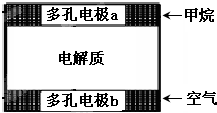 一种根据燃料电池原理设计瓦斯分析仪工作原理如右图所示,其中的固体电解质是Y2O3-Na2O,O2-可以在其中自由移动并与CO2结合为CO32-.下列有关叙述正确的是( )
一种根据燃料电池原理设计瓦斯分析仪工作原理如右图所示,其中的固体电解质是Y2O3-Na2O,O2-可以在其中自由移动并与CO2结合为CO32-.下列有关叙述正确的是( )| A、电极a反应式为:CH4+5O2--8e-=CO32-+2H2O |
| B、电极b是正极,O2-由电极a流向电极b |
| C、瓦斯分析仪工作时,电池内电路中电子由电极a流向电极b |
| D、当固体电解质中有1mol O2-通过时,电子转移4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、上述燃料电池的负极反应材料是氢气、甲烷、乙醇等物质 |
| B、氢氧燃料电池常用于航天飞行器,原因之一是该电池的产物为水,经过处理之后可供宇航员使用 |
| C、乙醇燃料电池的电解质常用KOH,该电池的负极反应为C2H5OH-12e-═2CO2↑+3H2O |
| D、KOH作电解质的甲烷燃料电池的正极反应为O2+2H2O+4e-═4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
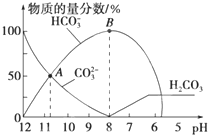 常温下,在10mL 0.1mol?L-1 Na2CO3溶液中逐滴加入0.1mol?L-1 HCl溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示(CO2因逸出未画出,忽略因气体逸出引起的溶液体积变化),下列说法正确的是( )
常温下,在10mL 0.1mol?L-1 Na2CO3溶液中逐滴加入0.1mol?L-1 HCl溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示(CO2因逸出未画出,忽略因气体逸出引起的溶液体积变化),下列说法正确的是( )| A、在0.1 mol?L-1 Na2CO3溶液中:c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-) |
| B、当溶液的pH为7时,溶液的总体积为20 mL |
| C、在B点所示的溶液中,浓度最大的阳离子是Na+ |
| D、在A点所示的溶液中:c(CO32-)=c(HCO3-)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cl的气态氢化物比S的稳定 |
| B、Cl原子最外层电子数比S原子最外层电子数多 |
| C、Cl2能从Na2S水溶液中置换S出来 |
| D、Cl的最高价氧化物的水化物酸性比S的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、v(N2)正=v(NH3)逆 |
| B、单位时间内3molH-H键断裂,同时6mol N-H键断裂 |
| C、n(N2):n(H2):(NH3)=1:3:2 |
| D、反应混合物各组分的物质的量浓度还在改变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com