
【题目】活性氮原子与二氧化氮反应(N+NO2)同时有四组气体产物:①N2O+O;②2NO;③N2+2O;④N2+O2。测得产物气体平均相对分子质量为28.7,第③组产物所占比例为
A.13%B.23%C.33%D.43%
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知:Kb(NH3·H2O)=1.76×10-5。25℃时,分别向浓度均为0.1mol/L,体积均为20mL的HX和HY的溶液中滴入等物质的量浓度的氨水,溶液中水电离出的c水(H+)与加入氨水的体积变化关系如图所示。下列说法正确的是

A. HX的电离方程式为HX==H++X-
B. b点时溶液中c(NH4+)=c(Y-)>c(H+)=c(OH-)
C. 其中一种酸的电离度为0.1%
D. a点溶液呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取未知浓度的硫酸、盐酸和醋酸各25.00mL,分别用0.10mol/L的NaOH溶液或0.10mol/L的稀氨水滴定得到下图曲线。下列说法正确的是
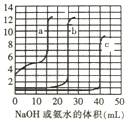
A. 由图可知曲线c为NaOH滴定硫酸
B. 由图可知硫酸的物质的量浓变大于盐酸的物质的量浓度
C. 曲线b、c的滴定实验可用酚酞做指示剂
D. 由图可知滴定前醋酸的物质的量浓度为0.060mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分, 针对表中的①~⑨种元素,填写下列空白:
主族 周期 | I A | IIA | IIIA | IVA | V A | VIA | VIIA | 0族 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ |
(1) 在这些元素中,在这些元素中,化学性质最不活泼的是:________________(填具体元素符号,下同)。
(2) 在最高价氧化物的水化物中,酸性最强的化合物是_________,碱性最强的化合物是/span>_________。
(3) 最高价氧化物是两性氧化物的元素是_________。
(4) 元素④与⑥形成的化合物属于___________________ (填“共价”或“离子”)化合物。
(5)①与⑦形成的化合物的化学式 __________________。
(6)写出⑥的原子结构示意图_____________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常利用含硫废水生产Na2S2O35H2O,实验室可用如下装置模拟生成过程。
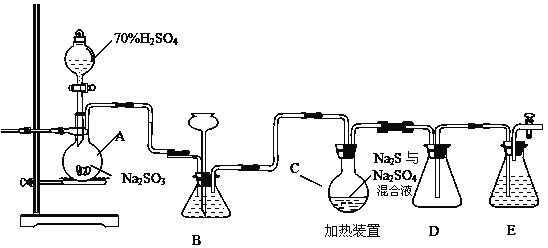
烧瓶C中发生反应如下:
Na2S(aq)+H2O(l)+SO2(g)=Na2SO3(aq)+H2S(aq) (I)
2H2S(aq)+SO2(g)=3S(s)+2H2O(l) (II)
S(s)+Na2SO3(aq)![]() Na2S2O3(aq) (III)
Na2S2O3(aq) (III)
(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液注,若 __________________________,则整个装置气密性良好。装置D的作用是___________________________。装置E中为___________溶液。
(2)为提高产品纯度,应使烧瓶C中Na2S和Na2SO3恰好完全反应,则烧瓶C中Na2S和Na2SO3物质的量之比为______________。
(3)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择__________ 。
a.蒸馏水 b.饱和Na2SO3溶液
c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
(4)实验中,为使SO2缓慢进入烧瓶C,采用的操作是____________。
(5)已知反应(III)相对较慢,则烧瓶C中反应达到终点的现象是_______________。反应后期可用酒精灯适当加热烧瓶A,实验室用酒精灯加热时必须使用石棉网的仪器含有___________________。
a .烧杯 b .蒸发皿 c.试管 d .锥形瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为确定混合均匀的NH4NO3和(NH4)2SO4样品组成,称取4份样品分别加入50.0mL相同浓度的NaOH溶液中,加热充分反应(溶液中的铵根离子全部转化为氨气,且加热后氨气全部逸出).加入的混合物的质量和产生的气体体积(标准状况)的关系如表:
实验序号 | I | II | III | IV |
NaOH溶液的体积(mL) | 50.0 | 50.0 | 50.0 | 50.0 |
样品质量(g) | 3.44 | m | 17.2 | 21.5 |
NH3体积(L) | 1.12 | 2.24 | 5.60 | 5.60 |
试计算:
(1)m=_____g;c(NaOH)=_____molL﹣1。
(2)样品中NH4NO3和(NH4)2SO4物质的量之比为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢化钙(CaH2)固体是登山运动员常用的能源提供剂。氢化钙要密封保存,一旦接触到水就发生反应生成氢氧化钙和氢气。氢化钙道常用氢气与纯净的金属钙加热制取,如图是模拟制取装置:
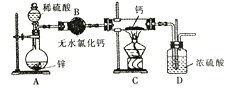
(1)为了确认进入装置C的氢气已经干燥应在B、C之间再接一装置,该装置中加入的试剂是______________。
(2)该实验步骤如下:检查装置气密性后装入药品;打开分液漏斗活塞,接下来的操作顺序是_______(填序号)。
①加热反应一段时间 ②收集气体并检验其纯度
③关闭分液漏斗活塞 ④停止加热,充分冷却
(3)某同学取一定质量的产物样品(m1g),加入过量碳酸钠溶液,过滤、洗涤、干燥后称量固体碳酸钙质量(m2g),计算得到样品中氢化钙的质量分数为101.14%。若该同学所有操作均正确,则产生这种情况的原因可能是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象预测、实验设计、仪器使用能达到目的是
A. 模拟工业制氨气并检验产物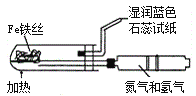
B. 实验室采用所示装置收集SO2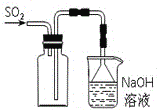
C. 验证KMnO4,Cl2,S 氧化性强弱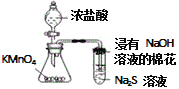
D. 验证铁发生析氢腐蚀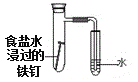
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、稀盐酸、澄清石灰水、氯化铜溶液是常见的物质,四种物质间的反应关系如图所示。图中两圆相交部分(A、B、C、D)表示物质间的反应,其中对应反应的离子方程式书写正确的是( )
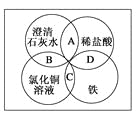
A. OH-+HCl===H2O+Cl-
B. Ca(OH)2+Cu2+===Ca2++Cu(OH)2
C. Fe+Cu2+===Cu+Fe2+
D. Fe+2H+===Fe3++H2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com