
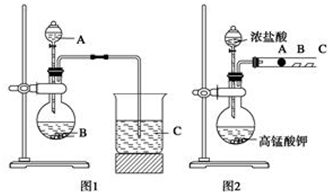
分析 (1)根据信息知道:甲同学根据元素非金属性与对应最高价含氧酸之间的关系如图1装置来一次性完成N、C、Si三种非金属元素的非金属性强弱比较,根据强酸制弱酸来回答即可,装置证明:酸性:HNO3>H2CO3>H2SiO3;
(2)图1中C处为二氧化碳与硅酸钠反应生成硅酸沉淀和碳酸钠,据此分析实验现象,硝酸易挥发,硝酸进入C中与硅酸钠反应生成硅酸,不一定为二氧化碳和硅酸钠的反应;
(3)探究氯、溴、碘的非金属性强弱的递变规律,根据实验装置图可知,实验原理为圆底烧瓶中:浓盐酸与高锰酸钾反应生成氯气,氯气通入A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润红纸试管,溴化钠,溶液出现红色,有溴单质生成,说明氯的非金属性强于溴,湿润的淀粉KI试纸试纸变蓝,湿润红纸褪色.
利用如图装置证明溴单质氧化性强于碘单质的氧化性,B处发生的是溴和碘离子的反应生成碘单质,碘单质遇淀粉变蓝.
解答 解:(1)根据题干信息:甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成同主族元素非金属性强弱比较的实验研究,硝酸的酸性强于碳酸,碳酸酸性强于硅酸,最高价氧化物对应水化物酸性越强,则原子的非金属性越强,依据强酸制弱酸来设计反应,所以A为硝酸,B为碳酸钙,C为硅酸钠溶液,硝酸与碳酸钙反应生成二氧化碳、硝酸钙和水,其反应的离子方程式为:CaCO3+2H+═Ca2++2CO2↑+H2O;二氧化碳与硅酸钠反应生成硅酸沉淀和碳酸钠,其反应的离子方程式为:SiO32-+CO2+H2O═H2SiO3↓+CO32-,
故答案为:强酸制弱酸;碳酸钙;硅酸钠溶液;
(2)二氧化碳通入硅酸钠溶液生成硅酸沉淀,装置C中反应是:CO2+SiO32-+H2O=H2SiO3↓+CO32-,硝酸易挥发,硝酸进入C中与硅酸钠反应生成硅酸,所以不能确定C中反应物时二氧化碳还是硝酸;
故答案为:白色沉淀;硝酸易挥发,硝酸进入C中与硅酸钠反应生成硅酸;
(3)利用如图装置证明氯气氧化性强于溴单质的氧化性,C中发生的是氯气和溴离子的反应生成溴单质2Br-+Cl2?Br2+2Cl-,溴单质与碘离子反应,反应的离子方程式为:2I-+Br2?I2+2Br-,碘单质遇淀粉变蓝,
故答案为:试纸变蓝色;2I-+Br2?I2+2Br-.
点评 本题考查了酸性强弱的比较实验设计,试剂选择,离子方程式的书写,熟练掌握物质性质是解题关键,题目难度中等,侧重于考查学生的实验设计能力和对基础知识的应用能力.


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

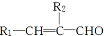 +H2O
+H2O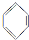 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$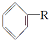 +HCl
+HCl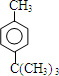 ;
;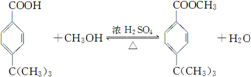 ;
;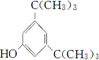 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 滴定次数 | 待测液体积(mL) | 标准NaOH溶液体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 25.00 | 10.80 | 30.70 |
| 第二次 | 25.00 | 14.20 | 34.30 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
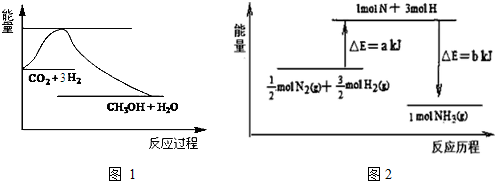
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com