
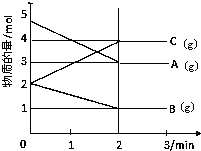
 某可逆反应从0-2分钟进行过程中,在不同反应时间各物质的量的变化情况如图所示.
某可逆反应从0-2分钟进行过程中,在不同反应时间各物质的量的变化情况如图所示. 2C,故答案为:2A+B
2C,故答案为:2A+B 2C;
2C;

科目:高中化学 来源: 题型:
| A、分子式为C4H8有机物最多存在4个C-C单键 |
B、 和 和 均是芳香烃, 均是芳香烃, 既是芳香烃又是芳香化合物 既是芳香烃又是芳香化合物 |
C、 和 和 分子组成相差一个-CH2-,因此是同系物关系 分子组成相差一个-CH2-,因此是同系物关系 |
| D、分子式为C2H6O的红外光谱图上发现有C-H键和C-O键的振动吸收,由此可以初步推测有机物结构简式为C2H5-OH |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
+ 4 |
+ 4 |
+ 4 |
+ 4 |
+ 4 |
+ 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
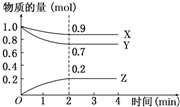 某温度时,在2L容器中X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试回答:
某温度时,在2L容器中X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试回答:查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示,甲、乙两池的电极材料都是铁棒与碳棒,请回答下列问题:
如图所示,甲、乙两池的电极材料都是铁棒与碳棒,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、N2 |
| B、C2H4 |
| C、C2H2 |
| D、HCl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com