
常温下,对下列四种溶液的叙述正确的是
| ① | ② | ③ | ④ | |
| 溶液 | 氨水 | 氢氧化钠溶液 | 醋酸溶液 | 盐酸 |
| pH | 11 | 11 | 3 | 3 |
科目:高中化学 来源: 题型:
| 元素 | A | B | C | D |
| 性质或结构信息 | 单质常温下为固体,难溶于水易于溶CS2.能形成2种二元含氧酸. | 原子的M层有1个未成对的p电子.核外p电子总数大于7. | 单质曾被称为“银色的金子”.与锂形成的合金常用于航天飞行器.单质能溶强酸和强碱. | 原子核外电子层上s电子总数比p电子总数少2个.单质和氧化物均为空间网状晶体,具有很高的熔、沸点. |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
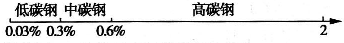
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | A | B | C | D |
| 性质 结构 信息 |
单质制成的高压灯,发出的黄光透雾力强、射程远. | 工业上通过分离液态空气获得其单质.原子的最外层未达到稳定结构. | 单质常温、常压下是气体,原子的L层有一个未成对的p电子. | +2价阳离子的核外电子排布与氖原子相同. |
查看答案和解析>>
科目:高中化学 来源: 题型:
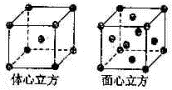 (2009?海口模拟)Mn、Fe均为第四周期过渡元素,两元素的部分电离能(I)数据列于下表:
(2009?海口模拟)Mn、Fe均为第四周期过渡元素,两元素的部分电离能(I)数据列于下表:| 元素 | Mn | Fe | |
| 电离能/kJ?mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 铜是人类最早使用的金属,被广泛应用于电气、轻工、机械制造和国防工业等.已知Cu2O与H2SO4能发生反应:Cu2O+H2SO4=Cu+CuSO4+H2O.
铜是人类最早使用的金属,被广泛应用于电气、轻工、机械制造和国防工业等.已知Cu2O与H2SO4能发生反应:Cu2O+H2SO4=Cu+CuSO4+H2O.
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com