

 ,
, ;
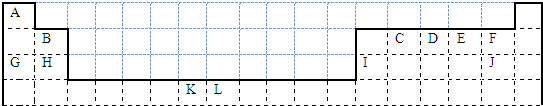
;| 1 |
| 8 |
| 1 |
| 2 |


 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:
| 物质 | 熔点/℃ | 沸点/℃ | 密度/(g/cm3) |
| 乙醇 | -144 | 78 | 0.789 |
| 乙酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.90 |
| 浓硫酸 | -- | 338 | 1.84 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 450 | 750 | 800 | 900 |
| 平衡常数 | 3.5 | 1.8 | 1.0 | 0.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
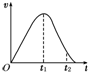 把除去氧化膜的镁条放入盛有一定浓度的稀盐酸的试管中,发现H2的生成速率v随时间t的变化关系如图所示.其中O~t1段速率变化的主要因素是
把除去氧化膜的镁条放入盛有一定浓度的稀盐酸的试管中,发现H2的生成速率v随时间t的变化关系如图所示.其中O~t1段速率变化的主要因素是查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 结构或性质信息 |
| A | 原子核外有一个未成对电子,其氢化物与水分子间能形成氢键 |
| B | 原子核外M层电子数是N层电子数的4倍 |
| C | 是使用最为广泛的合金的主要成分 |
| D | 原子各内层电子均已饱和,最外层电子数为1 |
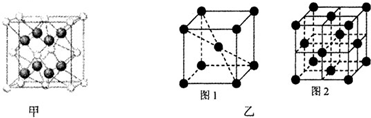
查看答案和解析>>
科目:高中化学 来源: 题型:
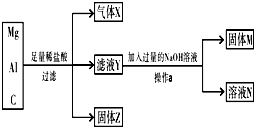 用镁粉、铝粉和炭粉组成的混合物进行如图所示实验,回答下列问题.
用镁粉、铝粉和炭粉组成的混合物进行如图所示实验,回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:
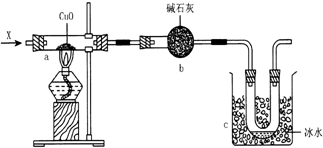
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com