

| A. | c(NH+4)相等的①NH4Cl②(NH4)2SO4③NH4HSO4溶液中,pH大小:①>②>③ | |
| B. | 0.1mol/LNa2S溶液:c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| C. | 25℃时,pH=2的CH3COOH与pH=12的NaOH溶液等体积混合:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| D. | 已知酸性HF>CH3COOH,pH相等的NaF与CH3COOK溶液中:[c(Na+)-c(F-)]<[c(K+)-c(CH3COO-)] |
分析 A.根据NH4+ 的水解程度分析;
B.根据质子守恒分析;
C.25℃时,pH=2的CH3COOH溶液中c(CH3COOH)>10-2mol/L,pH=12的NaOH溶液中c(NaOH)=10-2mol/L,二者混合醋酸过量,溶液显酸性;
D.根据电荷守恒分析.
解答 解:A.c(NH4+)相等的①NH4Cl②(NH4)2SO4③NH4HSO4溶液中,①②中NH+4的浓度的水解程度相同,所以pH相同,③中硫酸氢根离子电离出氢离子pH较小,所以pH大小:①=②>③,故A错误;
B.0.1mol/LNa2S溶液中水电离的氢离子等于氢氧根离子,则c(OH-)=c(H+)+c(HS-)+2c(H2S),故B错误;
C.25℃时,pH=2的CH3COOH溶液中c(CH3COOH)>10-2mol/L,pH=12的NaOH溶液中c(NaOH)=10-2mol/L,二者混合醋酸过量,溶液显酸性,所以溶液中离子浓度大小比较c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故C正确;
D.pH相等的NaF与CH3COOK溶液中,分别存在电荷守恒为c(Na+)+c(H+)=c(F-)+c(OH-),c(K+)+c(H+)=c(CH3COO-)+c(OH-),所以:[c(Na+)-c(F-)]=[c(K+)-c(CH3COO-)=c(OH-)-c(H+),故D错误.
故选C.
点评 本题考查盐的水解、酸碱混合溶液中离子浓度大小的比较,明确酸碱混合后溶液中的溶质及量的关系是解答本题的关键,并利用电离、水解、电荷守恒、物料守恒等知识来解答,题目难度中等.


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操作及现象 | 结论 |
| A | 取少量溶液于试管中,滴加BaCl2溶液,有白色沉淀生成,加稀硝酸沉淀不溶解 | 溶液中含有Ag+或SO42- |
| B | 取少量溶液于试管中,滴加新制氯水,溶液由无色变为黄色 | 溶液中含有Br- |
| C | 取少量溶液于试管中,滴加浓氢氧化钠溶液,微热,试管口湿润的红色石蕊试纸变蓝 | 溶液中含有NH4+ |
| D | 取少量溶液于试管中,滴加新制氯水后再滴加KSCN溶液,溶液变红色 | 原溶液中含有Fe2+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 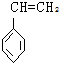 | B. | 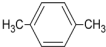 | C. | 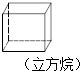 | D. | 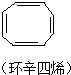 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 任何钠盐放人水中均不水解 | |
| B. | 可溶性铝盐溶于水都能水解 | |
| C. | NaC1水解后溶液呈中性 | |
| D. | NaHCO3溶液中只存在水解平衡不存在电离平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
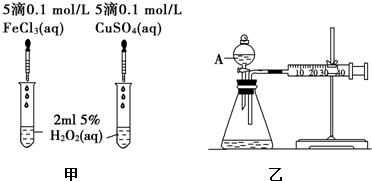
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com