
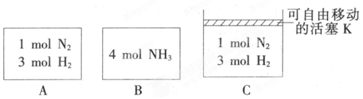
分析 ①A为恒容容器,C为恒压容器,随着反应的进行,容器体积减小,则C相当于对A加压,根据压强对平衡的影响分析;
②因体积相同,将乙中的量极限转化后为甲中的2倍,则压强大于甲中的压强,减小氨气的转化率;
③根据已知数据列三段式计算,根据恒压条件下物质的量之比等于体积比.
解答 解:①A为恒容容器,C为恒压容器,该反应气体体积减小,随着反应的进行,容器体积减小,则C相当于对A加压,增大压强,平衡正向移动,氨气的浓度增大,所以C容器内氨气浓度大;
故答案为:<;
②因体积相同,将乙中的量极限转化后为甲中的2倍,则压强大于甲中的压强,增大压强向生成氨气的方向移动,所以减小了氨气的转化率,所以α(A)+α(B)<1,
故答案为:<;
③对反应列三段式有:
N2 (g)+3H2(g)?2NH3(g)
n始:1 3 0
n转:x 3x 2x
n平:1-x 3-3x 2x
达到平衡时,容器C的体积是起始时$\frac{3}{4}$,则$\frac{2x+3-3x+1-x}{1+3}$=$\frac{3}{4}$,解得x=0.5,则平衡时容器C中H2的体积分数为$\frac{3-3×0.5}{2×0.5+1-0.5+3-3×0.5}×100%$=50%,
故答案为:50%.
点评 本题考查化学平衡的计算,影响平衡的因素,将不同模型转化为影响平衡的一般因素是解决本题的关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 新的平衡体系中,N2的浓度小于2c mol/L大于c mol/L | |
| B. | 新的平衡体系中,NH3的浓度小于2c mol/L大于c mol/L | |
| C. | 新的平衡体系中,混合气体的平均摩尔质量小于$\overline{M}$ | |
| D. | 新的平衡体系中,气体的密度是原平衡体系的1倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 三硫化磷(P4S3)是黄绿色针状晶体,易燃、有毒,分子结构之一如图所示,已知其燃烧时P被氧化为P4010,下列有关P4S3的说法中不正确的是( )
三硫化磷(P4S3)是黄绿色针状晶体,易燃、有毒,分子结构之一如图所示,已知其燃烧时P被氧化为P4010,下列有关P4S3的说法中不正确的是( )| A. | P4S3中磷元素为+3价 | |
| B. | P4S3属于共价化合物 | |
| C. | P4S3充分燃烧的化学方程式为P4S3+8O2=P4O10+3SO2 | |
| D. | 1 mol P4S3分子中含有9 mol共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/min | CO | H2O(g) | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | 0.100 | 0.200 | 0.100 | 0.100 |
| 4 | 0.100 | 0.200 | 0.100 | 0.100 |
| 5 | 0.116 | 0.216 | 0.084 | C1 |
| 6 | 0.096 | 0.266 | 0.104 | C2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 化合物 | HCl | NaOH | Cu2(OH)2SO4 | FeSO4•7H2O |
| 氧化物 | H2O | Na2O | CO | Fe3O4 |
| 电解质 | 食盐水 | SO2 | H2SO4 | 铁 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
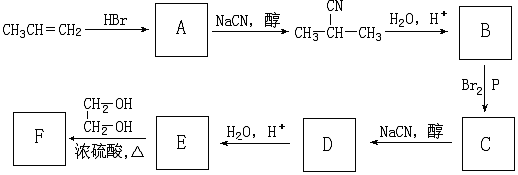
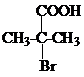 +NaCN$\stackrel{醇}{→}$NaBr+
+NaCN$\stackrel{醇}{→}$NaBr+ ,E→F(F为高分子时)nHOOC-C(CH3)2-COOH+nHOCH2CH2OH$→_{△}^{浓硫酸}$
,E→F(F为高分子时)nHOOC-C(CH3)2-COOH+nHOCH2CH2OH$→_{△}^{浓硫酸}$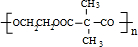 +2nH2O.
+2nH2O.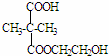 ,②分子内含有一个七元环
,②分子内含有一个七元环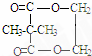 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com