
| A. | 5.6﹕1 | B. | 9﹕1 | C. | 1﹕5.6 | D. | 1﹕9 |
分析 某温度下,水的电离平衡常数K电离=1.8×10-15,可知中性时7<pH<8,所得混合溶液的pH=10,可知强碱过量,设强碱与强酸的体积分别为x、y,则$\frac{x×\frac{1.8×1{0}^{-15}}{1{0}^{-12}}-y×1{0}^{-2}}{x+y}$=$\frac{1.8×1{0}^{-15}}{1{0}^{-10}}$,以此来解答.
解答 解:某温度下,水的电离平衡常数K电离=1.8×10-15,所得混合溶液的pH=10,可知强碱过量,设强碱与强酸的体积分别为x、y,
则$\frac{x×\frac{1.8×1{0}^{-15}}{1{0}^{-12}}-y×1{0}^{-2}}{x+y}$=$\frac{1.8×1{0}^{-15}}{1{0}^{-10}}$,解得x:y≈5.6﹕1,
故选A.
点评 本题考查酸碱混合的计算,为高频考点,把握混合后碱过量、pH与浓度的关系为解答的关键,侧重分析与计算能力的考查,注意电离平衡常数的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 根据物质能否导电将物质分为电解质和非电解质 | |
| B. | 根据反应中的热效应将化学反应分为放热反应和吸热反应 | |
| C. | 根据溶液导电性强弱将电解质分为强电解质和弱非电解质 | |
| D. | 根据元素的化合价的高低将化学反应分为氧化还原反应和非氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | A(g)+B(g)→C(g)+D(l)是放热反应 | |
| B. | A(g)+B(g)→C(g)+D(l)是吸热反应 | |
| C. | C(g)+D(l)→A(g)+B(g)是放热反应 | |
| D. | C(g)+D(l)具有的能量大于A(g)+B(g)具有的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn|H2SO4(稀)|C | B. | Cu|AgNO3(aq)|Ag | C. | Zn|CCl4|Cu | D. | Fe|H2SO4(稀)|Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
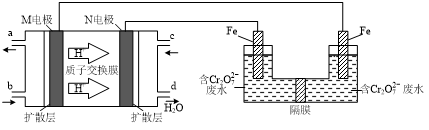
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
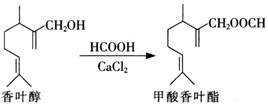
| A. | 香叶醇分子中含有1个手性碳原子 | |
| B. | 香叶醇可发生消去、加成、氧化反应 | |
| C. | 1 mol甲酸香叶酯可以与1molNaOH反应 | |
| D. | 甲酸香叶酯分子中所有碳原子均可能共平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇与浓氢溴酸反应:CH3CH2OH+HBr $\stackrel{△}{→}$CH3CH2Br+H2O | |
| B. | 溴乙烷与氢氧化钠溶液共热:CH3CH2Br+NaOH$\stackrel{△}{→}$CH3CH2OH+NaBr | |
| C. | 苯酚钠溶液中通入少量二氧化碳: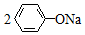 +CO2→ +CO2→ +Na2CO3 +Na2CO3 | |
| D. | 蔗糖在稀硫酸作用下水解:C12H22O11(蔗糖)+H2O$→_{△}^{稀硝酸}$C6H12O6(葡萄糖)+C6H12O6(果糖) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 组别 物质 | 甲 | 乙 | 丙 |
| A | Al2O3 | H2SO4 | NaOH |
| B | NO2 | HNO3 | NH3 |
| C | SiO2 | HF | NaOH |
| D | SO2 | Ca(OH)2 | NaHCO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com