
下列叙述正确的是( )
|
| A. | NaCl溶液在电流作用下电离成Na+与Cl﹣ |
|
| B. | 溶于水后能电离出H+的化合物都是酸 |
|
| C. | 液态氯化氢不能导电,但氯化氢是电解质 |
|
| D. | 导电性强的溶液里自由移动离子数目一定比导电性弱的溶液里自由移动离子数目多 |
考点:
电解质在水溶液中的电离;酸、碱、盐、氧化物的概念及其相互联系;电解质与非电解质.
专题:
电离平衡与溶液的pH专题.
分析:
A.电离是在水分子作用下或者通过加热使化学键断裂离解出自由移动的离子,不需要通电;NaCl溶液在电流作用下发生的是电解;
B.酸是指电离时生成的阳离子只有氢离子的化合物;
C.在水溶液中或者熔融状态下能导电的化合物是电解质;
D.电解质导电能力强弱与自由移动的离子的浓度,所带的电荷多少有关.
解答:
解:A.NaCl溶液在电流作用下发生的是电解生成氯气、氢气、氢氧化钠,氯化钠在水溶液中或者在熔融状态下电离成Na+与Cl﹣,故A错误;
B.NaHSO4电离方程式为:NaHSO4=Na++H++SO42﹣,NaHSO4属于盐,不是酸,故B错误;
C.虽然液体氯化氢不能导电,但是氯化氢在水溶液中能导电,是化合物,属于电解质,故C正确;
D.电解质导电能力强弱与自由移动的离子的浓度,所带的电荷多少有关,故D错误;
故选:C.
点评:
本题考查了电解质、酸、电离、电解的概念,题目简单,要求同学们加强基本概念的理解和记忆,以便灵活应用,注意电离和电解的条件.


科目:高中化学 来源: 题型:
下列有关工业生产的叙述正确的是
A.合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率
B.硫酸工业中,在接触室安装热交换器是为了利用SO3转化为H2SO4时放出的热量
C.电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极室生产的Cl2进入阳极室
D.电解精炼铜时,同一时间内阳极溶解铜的质量比阴极析出铜的质量小
查看答案和解析>>
科目:高中化学 来源: 题型:
下图是部分短周期元素的单质及其化合物的转化关系图(有关反应的条件及生成的H2O已略去),已知:(a)A、B、C、D是非金属单质,其中B、C、D在常温常压下是气体。(b)反应①、②是化工生产中的重要反应。(c)化合物E是形成酸雨的污染物之一,化合物K是常用的氮肥。(d)化合物L具有漂白性,可由Cl2与NaOH溶液反应而制得。(e)化合物J由两种元素组成,其相对分子质量为32。
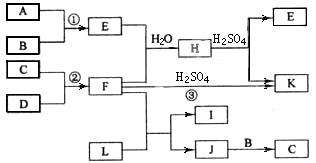
请按要求填空:
⑴反应③的化学方程式__________________________。
⑵C的结构式______________;H的化学式______________。
⑶L的溶液与化合物E反应的离子方程式__________________________。
⑷化合物J的化学式______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各溶液中,Na+物质的量浓度最大的是( )
|
| A. | 2L 0.5mol/L NaCl溶液 | B. | 3L 0.3mol/L Na2SO4溶液 |
|
| C. | 1L 0.4mol/L Na2CO3溶液 | D. | 4L 0.15mol/L Na3PO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
只能表示一个化学反应的离子方程式是( )
|
| A. | H++OH﹣=H2O |
|
| B. | 2H++CO32﹣=H2O+CO2↑ |
|
| C. | Cu(OH)2+2H+=Cu2++2H2O |
|
| D. | Mg2++2OH﹣+Ba2++SO42﹣=BaSO4↓+Mg(OH)2↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应中铁元素被还原的是( )
|
| A. | 2Fe(OH)3 | B. | Fe+CuSO4=Cu+FeSO4 |
|
| C. | Fe(OH)3+3HCl=FeCl3+3H2O | D. | 2Fe2O3+3C |
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)请把符合要求的化学方程式的字母填在下列空白处:
①既属于分解反应又是氧化还原反应的是 .
②既属于化合反应,又是氧化还原反应的是 .
③不属于四种基本反应类型的氧化还原反应的是 .
A.(NH4)2SO3 2NH3↑+H2O+SO2↑ B.2CO+O2
2NH3↑+H2O+SO2↑ B.2CO+O2 CO2
CO2
C. 2C+SiO2 Si+2CO↑ D.NH4NO3
Si+2CO↑ D.NH4NO3 N2O+2H2O
N2O+2H2O
E.CaCO3+CO2+H2O=Ca(HCO3)2F.MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(2)在氧化还原化学反应中(2CuO+C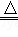 2Cu+CO2),物质所含元素化合价升高,这种物质是 剂,在反应中 (“得”或“失”)电子;元素化合价降低,表明该元素的原子在反应中 (“得”或“失”)电子.
2Cu+CO2),物质所含元素化合价升高,这种物质是 剂,在反应中 (“得”或“失”)电子;元素化合价降低,表明该元素的原子在反应中 (“得”或“失”)电子.
(3)鲜榨苹果汁是人们喜爱的饮料.由于此饮料中含有Fe2+,现榨的苹果汁在空气中会由淡绿色的Fe2+变为棕黄色Fe3+.这个变色的过程中的Fe2+被 (“氧化”或“还原”).若在榨汁的时候加入适量的维生素C,可有效防止这种现象的发生.这说明维生素C有 (“氧化”或“还原”)性.
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液可能含有Cl–、SO42–、CO32–、NH4+、Fe2+、Al3+和K+。取该溶液100 mL,加入过量NaOH溶液,加热,得到0. 02 mol气体,同时产生沉淀;过滤、洗涤、灼烧,得到1.6 g红棕色固体;向上述滤液中加入足量BaCl2溶液,得到4.66 g不溶于盐酸的沉淀。由此可知原溶液中( )
A.至少存在4种离子
B.Cl– 一定存在,且c(Cl )≥0.4 mol/L
C.SO42–、NH4+,一定存在,Cl–可能不存在
D.CO32–、Al3+ 一定不存在,K+可能存在
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com