
| A、加热NH4C1晶体时,将湿润的红色石蕊试纸靠近试管口,检验NH3的生成 |
| B、向某溶液中加入足量盐酸酸化,无现象,再加入BaCl2溶液,有白色沉淀生成,说明原溶液中存在SO42- |
| C、取少量溶液X,向其中加入适量新制氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+ |
| D、用饱和碳酸钠溶液除去二氧化碳中的氯化氢 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
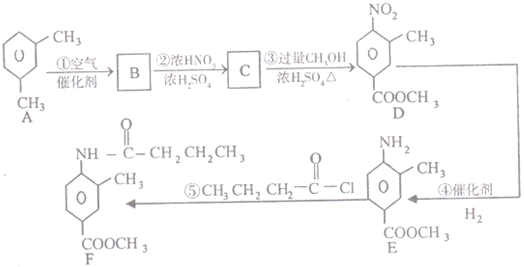
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、自来水 |
| B、0.5mol?L-1盐酸 |
| C、0.25mol?L-1H2SO4 |
| D、0.5mol?L-1NH4NO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用烧杯或烧瓶给液体物质加热时,要垫石棉网 |
| B、使用试纸检验溶液的性质时,应将试纸浸入溶液中 |
| C、用托盘天平称量氢氧化钠固体时,应将药品放在天平左盘的称量纸上 |
| D、如果某溶液中滴加BaCl2 溶液有白色沉淀生成,证明原溶液中一定含有SO42-离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、粉末中一定有Na2O,Na2O2,NaHCO3 |
| B、无法确定是否含有NaHCO3 |
| C、粉末中一定不含有Na2O和NaCl |
| D、无法确定是否含有Na2CO3和NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、镁粉中混有少量铝粉:加入过量烧碱溶液充分反应,过滤、洗涤、干燥 |
| B、用过量氨水除去Fe3+溶液中的少量Al3+ |
| C、Al(OH)3中混有少量Mg(OH)2:加入过量烧碱溶液充分反应,过滤,向滤液中通入过量CO2后过滤 |
| D、可以用过量氢氧化钠溶液除去MgO中的少量Al2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/ | 0 | 10 | 30 | 50 | 56.7 | 60 | 64 | 70 | 80 | 90 |
| 溶解度/ | 14.0 | 17.0 | 25.0 | 33.0 | 35.2 | 35.3 | 35.6 | 33.0 | 30.5 | 27.0 |
| 析出晶体 | FeSO4?7H2O | FeSO4?4H2O | FeSO4?H2O | |||||||
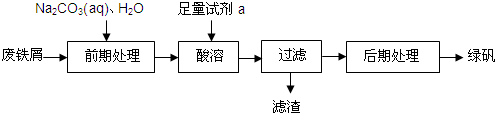
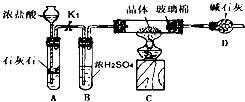
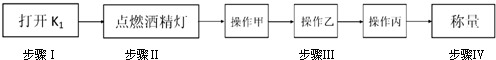
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、镁在空气中或纯净氧气中燃烧的产物都只有MgO |
| B、钠在敞口容器中存放或在空气中燃烧的产物都是Na2O2 |
| C、向NaOH溶液中通入少量CO2或过量CO2都只生成Na2CO3 |
| D、氯化铝和少量的氨水或过量的氨水反应都得到Al(OH)3沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com