
类推思维是化学解题中常用的一种思维方法,下列有关离子方程式的类推正确的是)
已知 | 类推 | |
A | 将Fe加入CuSO4溶液中 Fe+Cu2+=Cu+Fe2+ | 将Na加入到CuSO4溶液中 2Na+Cu2+=Cu+2Na+ |
B | 向稀硫酸加入NaOH溶液至中性 H++OH-=H2O | 向H2SO4溶液加入Ba(OH)2溶液至中性 H++OH-=H2O |
C | 向氯化铝溶液中加入足量NaOH溶液 Al3++4OH-=AlO2-+2H2O | 向氯化铝溶液中加入足量氨水 Al3++4NH3•H2O=AlO2-+2H2O+4NH4+ |
D | 向Ca(OH)2溶液中通入过量CO2 CO2+OH-=HCO3- | 向Ca(OH)2溶液中通入过量SO2 SO2+OH-=HSO3- |
 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案科目:高中化学 来源:2016-2017学年河南省高一上8月摸底化学试卷(解析版) 题型:实验题
实验室常用的制取气体的发生装置如下:

(1)仪器a的名称是___________; 搭建B装置时,酒精灯应在固体仪器a
搭建B装置时,酒精灯应在固体仪器a 之___________(选填“前”或“后”)放置。
之___________(选填“前”或“后”)放置。
(2)实验室用过氧化氢溶液和二氧化锰混合制取氧气,反应的化学方程式是_______________。
(3)在实验室制取二氧化碳的研究中,进行了如下实验:
药品 实验编号 | 甲 | 乙 | 丙 | 丁 |
大理石 | mg,块状 | mg,块状 | mg,粉末状 | mg,粉末状 |
盐酸(过量) | wg,稀盐酸 | wg,浓盐酸 | wg,稀盐酸 | wg,浓盐酸 |
①上述实验中反应的化学方程式是_____________________。
②若要研究盐酸浓度大小对反应的影响,可选择实验甲与___________对照(选填实验编号)。
③除盐酸的浓度外,上述实验研究的另一个影响反应因素是____________。
④研究发现酸的浓度越大,产生气体的速度越快。与甲比较,对丁分析正确的是___________。(选填编号)
A.反应更为剧烈 B.最终剩余溶液的质量更小
C.产生二氧化碳的质量更大 D.粉末状大理石利用率更高
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上开学测化学试卷(解析版) 题型:选择题
下列说法正确的是( )
A.离子键是阴、阳离子间存在的静电引力
B.只有金属和非金属化合时才能形成离子键
C.含有离子键的化合物一定是离子化合物
D.第ⅠA族和第ⅦA族元素原子化合时,一定形成离子化合物
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上开学测化学试卷(解析版) 题型:选择题
反应N2+3H2 2NH3刚开始时,N2的浓度为3mol/L,H2的浓度5mol/L,3min后测得NH3浓度为0.6mol/L,则此时间内,下列反应速率表示正确的是( )
2NH3刚开始时,N2的浓度为3mol/L,H2的浓度5mol/L,3min后测得NH3浓度为0.6mol/L,则此时间内,下列反应速率表示正确的是( )
A.v(NH3)=0.2mol/(L·min) B.v(N2)=1mol/(L·min)
C.v(H2)=1.67mol/(L·min) D.v(H2)=1.37mol/(L·min)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上开学测化学试卷(解析版) 题型:选择题
某气体由常见的一种或多种气体组成,经测定其中只含有碳、氧两种元素,碳、氧元素的质量比为3:8,则关于该气体的说法正确的( )是
A.该气体一定是纯净物
B.该气体一定是CO、CO2的混合物
C.该气体中所含的物质最多只有2种
D.该气体可能含有3种成分
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上开学测化学试卷(解析版) 题型:选择题
下列有关试剂的保存方法,错误的是( )
A. 金属钠保存在煤油中
B. 存放FeSO4溶液时加入少量铁粉
C. NaOH溶液保存在带胶塞的玻璃试剂瓶中
D. 新制的氯水保存在无色广口瓶中
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省高二上开学测化学试卷(解析版) 题型:选择题
下面是某化学研究小组探究外界条件对化学反应速率和化学平衡影响的图像,其中图像和实验结论表达式均正确的是( )
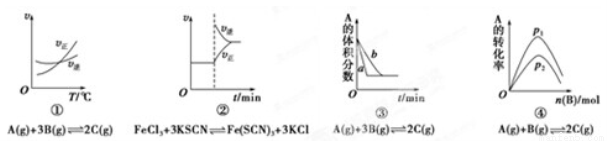
A.①是其他条件一定时,反应速率随温度变化的图象,正反应△H<0
B.②是在平衡体系的溶液中溶入少量KCl晶体后化学反应速率随时间变化的图象
C.③是在有无催化剂存在下建立的平衡过程图象,a是使用催化剂时的曲线
D.④是一定条件下,向含有一定量A的容器中逐渐加入B时的图象,压强p1>p2
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省高二上开学测化学试卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数,下列叙述正确的是( )
A.1molCl2参加反应转移电子数一定是2NA
B.常温常压下,NA和CH4分子占有的体积约为22.4L
C.常温常压下,1molNa2O2中阴离子为2NA个
D.标准状况下,11.2L16O2和11.2L18O2均含有NA个氧原子
查看答案和解析>>
科目:高中化学 来源:2017届云南省高三第一次摸底化学试卷(解析版) 题型:填空题
铜及其化合物在日常生活中应用广泛。某研究性学习小组欲从氯化铁溶液腐蚀印刷电路极后的酸性废液中(含FeCl3、FeCl2含CuCl2)制备氯化铜晶体(CuCl2·2H2O),设计路线如下:
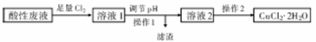
回答下列问题:
(1)检验酸性废液中含有Fe3+,常用的试剂是 (填化学式);酸性废液中加入足量Cl2,反应的化学方程式为 。
(2)操作1的名称是 ;调节溶液的pH时适宜选用下列试剂中的 ;
A.NaOH溶液 B.Na2CO3 C.氨水 D.CuO
若调节溶液的pH为4时,溶液中残留的Fe3+物质的量浓度为 (已知25℃时,Kap[Fe(OH)3]=4×10-38).
(3)操作2需在氯化氢气流中经过加热浓缩、 、过滤、洗涤、干燥。在氯化氢气流中进行操作的原因是 (结合离子方程式并简要说明)。
(4)若在溶液2中通入一定量的SO2,加热,则生成CuCl沉淀,该反应的离子方程式为 。
(5)该小组设想以铜棒和石墨棒为电极,以KI溶液为电解液,利用电解来制取碘化亚铜,
已知:2Cu2++4I-=2CuI↓+I2.若按其设想,铜棒应连接电源的 (填“正”或“负”)极;阴极发生的电极反应式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com