
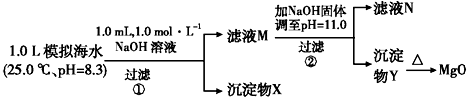
| 模拟海水中的离 子浓度/mol•L-1 | Na+ | Mg2+ | Ca2+ | Cl- | HCO3- |
| 0.439 | 0.050 | 0.011 | 0.560 | 0.001 |
| A. | 沉淀物X为CaCO3、MgCO3 | |
| B. | 滤液M中存在Mg2+,Ca2+ | |
| C. | 滤液N中存在Ca2+,没有Mg2+ | |
| D. | 步骤②中若改为加入4.2 g NaOH固体,沉淀物Y为仍Mg(OH)2,没有Ca(OH)2 |
分析 步骤①,加入0.001mol NaOH时,OH- 恰好与HCO3-完全反应,生成0.001molCO32-.由于Ksp(CaCO3)<<Ksp(MgCO3),生成的CO32-与水中的Ca2+反应生成CaCO3 沉淀,滤液M中同时存在着Ca2+和Mg2+;步骤②,当滤液M中加入NaOH 固体,调至pH=11时,此时滤液中c(OH-)=1×10-3 mol•L-1;
根据溶度积可判断无Ca(OH)2生成,有Mg(OH)2沉淀生成,由此分析解答.
解答 解:A.步骤①,从题给的条件,可知n(NaOH )=0.001mol,[即n(OH-)=0.001mol].依据离子反应“先中和、后沉淀、再其他”的反应规律,当1L模拟海水中,加入0.001mol NaOH时,OH- 恰好与HCO3-完全反应:OH-+HCO3-=CO32-+H2O,生成0.001molCO32-.由于Ksp(CaCO3)<<Ksp(MgCO3),生成的CO32-与水中的Ca2+反应生成CaCO3 沉淀Ca2++CO32-=CaCO3↓,所以沉淀物X为CaCO3,故A错误;
B.由于CO32-只有0.001mol,反应生成CaCO3 所消耗的Ca2+也只有0.001mol,滤液中还剩余c(Ca2+)=0.010 mol•L-1,滤液M中同时存在着Ca2+和Mg2+,故B正确;
C.步骤②,当滤液M中加入NaOH 固体,调至pH=11(即pOH=3)时,此时滤液中c(OH-)=1×10-3 mol•L-1.则
Q[Ca(OH)2]=c(Ca2+)×(10-3)2=0.010×(10-3)2=10-8<Ksp[Ca(OH)2],无Ca(OH)2生成.
Q[Mg(OH)2]=c(Mg2+)×(10-3)2=0.050×(10-3)2=5×10-8>Ksp[Mg(OH)2],有Mg(OH)2沉淀生成.
又由于Ksp[Mg(OH)2]=c(Mg2+)×(10-3)2=5.6×10-12,c(Mg2+)=5.6×10-6<10-5,无剩余,滤液N中不存在Mg2+,故C正确;
D.步骤②中若改为加入4.2 g NaOH固体,则n(NaOH)=0.105mol,与0.05mol Mg2+反应:Mg2++2OH-=Mg(OH)2↓,生成0.05 mol Mg(OH)2,剩余0.005 mol OH-.
由于Q[Ca(OH)2]=c(Ca2+)×(OH-)2=0.010×(0.005)2=2.5×10-7<Ksp[Ca(OH)2],所以无Ca(OH)2沉淀析出,沉淀物Y为Mg(OH)2沉淀,故D正确;故选A.
点评 本题考查了离子浓度及Ksp的有关计算,要求考生定量地分析发生的反应,溶液中存在的离子,推断沉淀是否产生,从而得出正确的结论.计算强调了实用性以及认识、解决问题的综合性,题目难度中等.


科目:高中化学 来源: 题型:填空题
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 对该反应体系加热 | B. | 不用稀硫酸,改用98%的浓硫酸 | ||
| C. | 加少量CuSO4溶液 | D. | 不用铁片,改用铁粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体带电荷,而溶液呈电中性 | |
| B. | 胶体中加入电解质可以产生沉淀,而溶液不能 | |
| C. | 胶体是一种不稳定分散系,而溶液是一种最稳定分散系 | |
| D. | 胶体具有丁达尔效应,而溶液不具有 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCO3和MgCl2 | B. | NH4F和NaF | C. | Na2O2和H2O2 | D. | H2O和SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
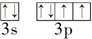 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com