
| 选项 | 实 验 事 实 | 理 论 解 释 |
| A. | SO2溶于水形成的溶液能导电 | SO2是电解质 |
| B. | 白磷为正四面体分子 | 白磷分子中P-P间的键角是109°28′ |
| C. | 1体积水可以溶解700体积氨气 | 氨是极性分子且由于有氢键的影响 |
| D. | HF的沸点高于HCl | H-F的键长比H-Cl的键长短 |
| A、A | B、B | C、C | D、D |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、10.8g | B、7.2g |
| C、2.7g | D、1.8g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗上口倒出 |
| B、用托盘天平准确称取5.85克NaCl |
| C、氢氧化钠溶液保存在带玻璃塞的试剂瓶中 |
| D、用广泛PH试纸测得0.10mol/LNH4Cl溶液的PH=5.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、化学家维勒,用无机化合物氰酸铵合成了有机化合物尿素,由此突破了了无机化合物和有机化合物的界限 |
| B、铵态氮肥不能与碱性物质如草木灰混合施用 |
| C、日益剧增的汽车,导致氮氧化物排放超标,是光化学烟雾的主要原因 |
| D、氧化钠是电解质,因为它的水溶液可以导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在用简易量热计测定反应热时,可使用碎泡沫起隔热保温的作用、普通玻璃棒进行搅拌使酸和碱充分反应、准确读取实验时温度计最高温度、取2-3 次的实验平均值等措施,以达到良好的实验效果 |
| B、纸上层析属于色谱分析法,其原理跟“毛细现象”相关,通常以滤纸作为惰性支持物,滤纸纤维吸附的水作为固定相 |
| C、检验氯乙烷中的氯元素时,将氯乙烷和NaOH溶液混合加热,用稀硫酸进行酸化后再加入硝酸银溶液 |
| D、酸式滴定管,碱式滴定管、移液管都是准确量取一定体积液体的仪器,它们在使用时都要进行检查是否漏水、水洗、润洗、注液、调整液面等几个过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、图1表示恒温恒压下条件,向2HI?H2+I2△H>0的反应达到平衡的容器中充入HI,甲表示正反应速率,乙表示逆反应速率 |
| B、图1表示恒容下条件,向2HI?H2+I2△H>0的反应达到平衡的容器加热,甲表示正反应速率,乙表示逆反应速率 |
| C、图2表示恒温条件下,压缩2SO3(g)?2SO2(g)+O2(g)△H>0平衡反应体系,甲表示的SO3物质的量的变化,乙表示的SO3物质的量浓度的变化 |
| D、图2表示恒容条件下,对于2SO3(g)?2SO2(g)+O2(g)△H>0反应平衡体系,甲表示升高温度SO3物质的量的变化,乙表示增加O2后SO3物质的量变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
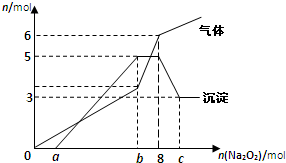
| A、2 mol、3 mol、6 mol |
| B、3 mol、2 mol、6mol |
| C、2 mol、3 mol、4 mol |
| D、3 mol、2 mol、2 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com