
| A. | Na2CO3 | B. | Na2O | C. | CaO | D. | Al(OH)3 |
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②④⑤ | C. | ③④⑤ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
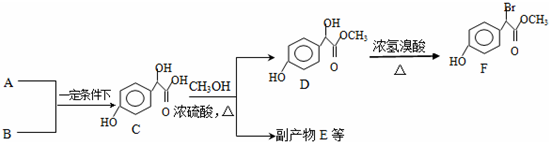
 .
.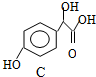 中①、②、③(从左到右编号)3个-OH的酸性由强到弱的顺序是:③>①>②.
中①、②、③(从左到右编号)3个-OH的酸性由强到弱的顺序是:③>①>②. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  向一定量的饱和石灰水中加入氧化钙 | |
| B. |  加热一定量高锰酸钾固体产生氧气 | |
| C. |  用一定量的双氧水制取氧气 | |
| D. |  向一定量的硝酸银溶液中插入铜丝 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+ Ag+ CO32- Cl- | B. | K+ Ba2+SO42- Cl- | ||
| C. | Na+ K+ CO32- Cl- | D. | Na+ K+ Cl- SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
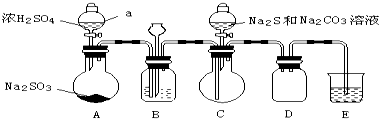
| 推测 | 操作和现象 | 结论 |
| 杂质中的正盐成分可能有: Na2S Na2CO3 Na2SO3 Na2SO4 | ①取Wg产品配成稀溶液; ②向溶液中滴加过量BaCl2溶液,有白色沉淀生成,过滤,得沉淀和滤液; ③向沉淀中加入过量盐酸,沉淀完全溶解,并有刺激性气味的气体产生. | 产品杂质中: 一定含有Na2SO3, 可能含有Na2CO3 Na2S, 一定不含有Na2SO4. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
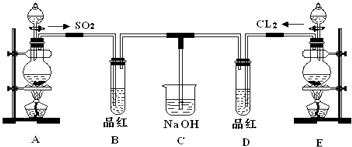
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com