
(8分)(I)已知:在298 K、1.01KPa下,由稳定的单质发生反应生成1 mol气态化合物的反应热叫该化合物的生成热(ΔH).如图所示为氧族元素氢化物a、b、c、d的生成热数据示意图.试回答下列问题: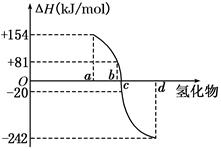
请你归纳出
(I)非金属元素氢化物的稳定性与其反应热ΔH的关系____________;
写出硒化氢在298 K、1.01KPa下,发生分解反应的反应热△H =______ KJ/mol。
(II)已知:拆开1mol Si—Si键,1mol O=O键,1mol Si—O键分别需要的能量是AkJ、BkJ、CkJ,则硅与氧气反应生成1molSiO2的反应热△H ="=" KJ/mol。
(III)一种新型燃料电池,一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-。写出该燃料电池的电极反应:
负极: 正极:
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
(8分) (I)已知:在298 K、1.01KPa下,由稳定的单质发生反应生成1 mol气态化合物的反应热叫该化合物的生成热(ΔH).如图所示为氧族元素氢化物a、b、c、d的生成热数据示意图.试回答下列问题:
请你归纳出
(I)非金属元素氢化物的稳定性与其反应热ΔH的关系____________;写出硒化氢在298 K、1.01KPa下,发生分解反应的反应热△H=______ KJ/mol。
(II)已知:拆开1mol Si—Si键,1mol O=O键,1mol Si—O键分别需要的能量是AkJ、BkJ、CkJ,则硅与氧气反应生成1molSiO2的反应热
△H == KJ/mol。
(III)一种新型燃料电池,一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇(Y2O3)
的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-。写出该燃料电池的电极反应:
负极: 正极:
查看答案和解析>>
科目:高中化学 来源:2011-2012学年河南省高三上学期10月份月考化学试卷 题型:填空题
18.(14分)氮是一种地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义。
(1)下图是1 mol NO2和1 mol CO反应生成CO2和NO过程中能量变化示意图,写出NO2和CO反应的热化学方程式 。
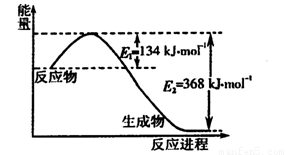
(2)已知:N2(g)+O2(g)=2 NO(g) △H=+180 kJ·mol-1
2NO(g)+2 CO(g)=N2(g)+2 CO2(g)△H=-746 kJ·mol-1
则反应CO(g)+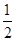 O2(g)=CO2(g)的△H=
kJ·mol-1
O2(g)=CO2(g)的△H=
kJ·mol-1
(3)在一固定容积为2L的密闭容器内加人0.2 mol的N2和0.6 mol的H2,在一定条件下发生如下反应。N2(g)+3H2(g)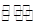 2NH3(g)△H<0,若第5分钟时达到平衡,此时测得NH3的物质的量为0.2 m01.则前5分钟的平均反应速率v(N2)为
,平衡时H2的转化率为
%,该反应的平衡常数K=
(mol·L-1)-2.
2NH3(g)△H<0,若第5分钟时达到平衡,此时测得NH3的物质的量为0.2 m01.则前5分钟的平均反应速率v(N2)为
,平衡时H2的转化率为
%,该反应的平衡常数K=
(mol·L-1)-2.
(4)在固定体积的密闭容器中.1.0×103kPa时反应N2(g)+3H2(g)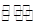 2NH3(g)
2NH3(g)
△H<0的平衡常数K与温度T的关系如下表:
|
T/K |
298 |
398 |
498 |
|
平衡常数K |
51 |
K1 |
K2 |
则K1 K2(填写“>”、“=”或“<”)
(5)在体积一定的密闭容器中能说明合成氨反应一定达到平衡状态的是 (填字母)
a.容器内N2、H2、NH3的浓度之比为I:3:2
b.NH3的浓度保持不变
c.容器内压强保持不变
d.混合气体的密度保持不变
查看答案和解析>>
科目:高中化学 来源:2011-2012学年新疆乌鲁木齐一中高三第三次月考化学试卷 题型:填空题
(8分) (I)已知:在298 K、1.01KPa下,由稳定的单质发生反应生成1 mol气态化合物的反应热叫该化合物的生成热(ΔH).如图所示为氧族元素氢化物a、b、c、d的生成热数据示意图.试回答下列问题:
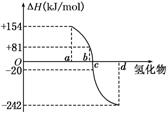
请你归纳出
(I)非金属元素氢化物的稳定性与其反应热ΔH的关系____________;写出硒化氢在298 K、1.01KPa下,发生分解反应的反应热△H =______ KJ/mol。
(II)已知:拆开1mol Si—Si键,1mol O=O键,1mol Si—O键分别需要的能量是AkJ、BkJ、CkJ,则硅与氧气反应生成1molSiO2的反应热
△H == KJ/mol。
(III)一种新型燃料电池,一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇(Y2O3)
的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-。写出该燃料电池的电极反应:
负极: 正极:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com