
| A. | 非金属性P<S | |
| B. | Na3PO4溶液呈碱性,Na2SO4溶液呈中性 | |
| C. | H3PO4溶液的导电能力弱于H2SO4溶液 | |
| D. | H2SO4溶液与Na3PO4反应可以生成H3PO4和Na2SO4 |
分析 A.非金属性越强,对应最高价含氧酸的酸性越强;
B.弱酸对应的盐可发生水解反应;
C.溶液导电性与离子浓度大小有关,与强弱电解质没有必然关系;
D.溶液中发生强酸制取弱酸的反应.
解答 解:A.非金属性P<S,则H3PO4的酸性弱于H2SO4,故A不选;
B.Na3PO4溶液呈碱性,Na2SO4溶液呈中性,可知硫酸为强酸,磷酸不是强酸,故B不选;
C.H3PO4溶液的导电能力弱于H2SO4溶液,溶液导电性与离子浓度大小有关,不能判断酸性强弱,故C选;
D.H2SO4溶液与Na3PO4反应可以生成H3PO4和Na2SO4,为强酸制取弱酸的反应,则H3PO4的酸性弱于H2SO4,故D不选;
故选C.
点评 本题考查酸性强弱比较,为高频考点,把握元素非金属性的比较方法、强酸制取弱酸的规律及盐类水解为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | H2O2分子中只存在极性键 | B. | NH3的结构式为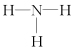 | ||
| C. | HCl的电子式为 | D. | 每个水分子内含有2个氢键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
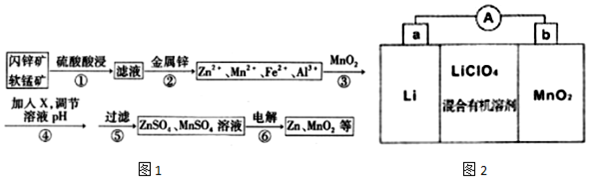
| Zn2+ | Mn2+ | Fe2+ | Fe3+ | Al3+ | |
| pH | 8.0 | 10.1 | 9.0 | 3.2 | 4.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
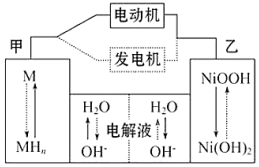
| A. | 充电时,阴极附近pH降低 | |
| B. | 电动机工作时溶液中OH-向甲移动 | |
| C. | 放电时正极反应式为:NiOOH+H2O+e-═Ni(OH)2+OH- | |
| D. | 电极总反应式为:MH+NiOOH$?_{充电}^{放电}$M+Ni(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
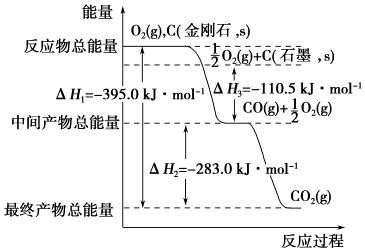
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径大小顺序:r(Y)>r(Z )>r(W)>r(M) | |
| B. | Z的气态氢化物比W的气态氢化物更稳定 | |
| C. | 分子式为Y5X12的物质只有3种 | |
| D. | 由三种元素X、Z、W形成的化合物中只有共价键而无离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2,2-二甲基丁烷与2,4-二甲基戊烷的一氯代物数目不相同 | |
| B. | 乙烷,苯,葡萄糖溶液均不能使酸性高锰酸钾溶液褪色 | |
| C. | 苯的密度比水小,但由苯反应制得的溴苯、硝基苯、环己烷的密度都比水大 | |
| D. | 与环己醇(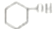 )互为同分异构体、且含有醛基(-CHO)的结构有8种(不含立体结构) )互为同分异构体、且含有醛基(-CHO)的结构有8种(不含立体结构) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在含A13+总数为NA的A1C13溶液中,C1-总数为3NA | |
| B. | 标准状况下,5.6L CO2中含有的共用电子对数为0.5NA | |
| C. | Na2O2与足量的CO2反应生成0.1mol O2,转移的电子数为0.2NA | |
| D. | 常温下,56g铁片投入足量浓H2SO4中,充分反应,生成NA个SO2分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验操作设计 | 现象记录 | 结论解释 | |
| A | 醋酸加入到碳酸钠固体中,将产生的气体通入C6H5ONa 溶液中 | 溶液变浑浊 | 酸性:CH3COOH>H2CO3>C6H5OH |
| B | CH3CH2Br 与NaOH 乙醇溶液共热产生的气体通入溴水中 | 溶液褪色 | 产生了乙烯 |
| C | 向某氯化亚铁溶液中加入加入Na2O2 粉末 | 出现红褐色沉淀 | 加入 Na2O2 粉末前,原氯化亚铁溶液已经变质 |
| D | 向紫色石蕊试液中持续长时 间通人氯气 | 溶液先变红,最后变为无色 | 氯气有漂白性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com