
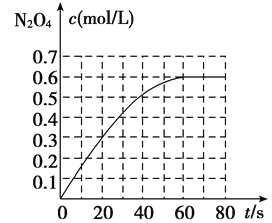
【题目】298 K时,在2 L固定体积的密闭容器中,发生可逆反应:2NO2(g) ![]() N2O4(g) ΔH=-a kJ/mol(a>0)。N2O4的物质的量浓度随时间变化如图。达平衡时,N2O4的浓度为NO2的2倍,若反应在398 K进行,某时刻测得n(NO2)=0.6 mol,n(N2O4)=1.2 mol,则此时,下列大小关系正确的是( )
N2O4(g) ΔH=-a kJ/mol(a>0)。N2O4的物质的量浓度随时间变化如图。达平衡时,N2O4的浓度为NO2的2倍,若反应在398 K进行,某时刻测得n(NO2)=0.6 mol,n(N2O4)=1.2 mol,则此时,下列大小关系正确的是( )
A. v(正)>v(逆)
B. v(正)<v(逆)
C. v(正)=v(逆)
D. v(正)、v(逆)大小关系不确定
【答案】B
【解析】试题分析:根据图示可知,在298K时,当反应达到平衡时c(N2O4)=0.6mol/L,由于平衡时,N2O4的浓度为NO2的2倍,则平衡时c(NO2)=0.3mol/L,则该温度下的化学平衡常数K= c(N2O4)/ c2(NO2)= 0.6mol/L÷(0.3mol/L)2=6.67L/mol;由于2NO2(g)![]() N2O4(g) △H=-akJ/mol(a>0)的正反应是放热反应,升高温度,化学平衡向吸热的逆反应方向移动,所以若反应在398K进行,反应达到平衡时的化学平衡常数K1<6.67。若反应在398K进行,某时刻测得n(NO2)=0.3mol/L、n(N2O4)=0.6mol/L,则Q= c(N2O4)/ c2(NO2)= 0.6mol/L÷(0.3mol/L)2=6.67L/mol,说明反应未处于平衡状态,反应逆向进行,因此v(正)<v(逆),选项B正确。
N2O4(g) △H=-akJ/mol(a>0)的正反应是放热反应,升高温度,化学平衡向吸热的逆反应方向移动,所以若反应在398K进行,反应达到平衡时的化学平衡常数K1<6.67。若反应在398K进行,某时刻测得n(NO2)=0.3mol/L、n(N2O4)=0.6mol/L,则Q= c(N2O4)/ c2(NO2)= 0.6mol/L÷(0.3mol/L)2=6.67L/mol,说明反应未处于平衡状态,反应逆向进行,因此v(正)<v(逆),选项B正确。


科目:高中化学 来源: 题型:
【题目】设NA为阿伏加罗常数的值,下列叙述正确的是( )
A.标准状况下,33.6L氟化氢中含有氟原子的数目为1.5NA
B.3mol铁与足量的水蒸气充分反应,转移8NA个电子
C.50mL18.4molL﹣1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA
D.某密闭容器盛有0.1molN2和0.3molH2 , 在一定条件下充分反应,转移电子的数目为0.6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于硫的说法不正确的是()
A.试管内壁附着的硫可用二硫化碳溶解除去
B.游离态的硫存在于火山喷口附近或地壳的岩层里
C.单质硫既有氧化性,又有还原性
D.硫在空气中的燃烧产物是二氧化硫,在纯氧气中的燃烧产物是三氧化硫
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=1的某溶液X中仅含有NH4+、Al3+、Ba2+、Fe2+、Fe3+、CO32﹣、SO32﹣、SO42﹣、Cl﹣、NO3﹣中的一种或几种(忽略水的电离及离子的水解),取该溶液进行连续实验,实验过程如图:下列有关推断不正确的是( )
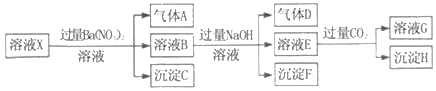
A. 溶液X中一定含有H+、Al3+、NH4+、Fe2+、SO42﹣
B. 根据上述连续实验不能确定溶液X中是否含有Fe3+、Cl﹣
C. 沉淀H为Al(OH)3、BaCO3的混合物
D. 若溶液X为100mL,产生的气体A为44.8mL(标准状况),则X中c(Fe2+)=0.06molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法中正确的是
A. 16g CH4含有的原子数为NA
B. 17 g OH- 含有的质子数为9NA
C. 2g D2气体中含有的中子数为0.5 NA
D. 标准状况下22.4 L NH3含有的电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于离子键、共价键的各种叙述中,说法正确的是( )
A.在离子化合物中,只存在离子键,没有共价键
B.非极性键只存在于双原子的单质分子中
C.在共价化合物分子内,一定不存在离子键
D.由不同元素组成的多原子分子里,一定只存在极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应原理揭示了不同的物质在水溶液中有不同的行为。请按要求回答下列问题:(已知:H2SO3: Ka1=1.7×10-2,Ka2=6.0×10-8 ; NH3·H2O:Kb=1.8×10-5)
(1)将等物质的量的SO2与NH3溶于水充分反应,所得溶液呈_________性,该溶液中各离子浓度由大到小的顺序为:_____________________________________________,所得溶液中c(H+)- c(OH-)=___________________________(填写表达式)

(2)用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如右图所示(电极材料为石墨)。
① 图中a极要连接电源的(填“正”或“负”)________极;C口流出的物质是________。
②SO32-放电的电极反应式为______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示。已知Y、Z两种元素的单质是空气的主要成分,W原子的最外层电子数与Ne原子的最外层电子数相差1。请回答下列问题:

(1)四种元素的所有化合价中,最低负化合价为______价,最高正化合价为_____价。
(2)甲和乙分别是由W、X、Y、Z四种元素中的三种元素组成的常见化合物,化合物甲具有消毒杀菌作用,其化学式为_________;化合物乙是一种离子化合物,常用作化肥,其化学式为________。
(3)HYO3的酸性比HWO强,有人据此认为Y的非金属性强于W,你认为这种看法是否正确,说明理由:____________________。
(4)元素Y和W能形成一种化合物YW3。YW3能发生水解反应生成一种弱碱和一种弱酸,写出该反应的化学方程式:________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com