
Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定。

Ⅰ.制备Na2S2O3·5H2O
反应原理:Na2SO3(aq)+S(s) Na2S2O3(aq)
Na2S2O3(aq)
实验步骤:
①称取15 g Na2SO3加入圆底烧瓶中,再加入80 mL蒸馏水。另取5 g研细的硫粉,用3 mL乙醇润湿,加入上述溶液中。
②安装实验装置(如图所示,部分夹持装置略去),水浴加热,微沸60 min。
③趁热过滤,将滤液水浴加热浓缩,冷却析出Na2S2O3·5H2O,经过滤、洗涤、干燥,得到产品。
回答问题:
(1)硫粉在反应前用乙醇润湿的目的是__________________________。
(2)仪器a的名称是________,其作用是____________________。
(3)产品中除了有未反应的Na2SO3外,最可能存在的无机杂质是______________。检验是否存在该杂质的方法是____________________________。
(4)该实验一般控制在碱性环境下进行,否则产品发黄,用离子反应方程式表示其原因:________________________________________________________________________
________________________________________________________________________。
Ⅱ.测定产品纯度
准确称取W g产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.100 0 mol·L-1碘的标准溶液滴定。
反应原理为2S2O +I2===S4O
+I2===S4O +2I-
+2I-
(5)滴定至终点时,溶液颜色的变化:____________________________________________。
(6)滴定起始和终点的液面位置如图,则消耗碘的标准溶液体积为__________mL。产品的纯度为(设Na2S2O3·5H2O相对分子质量为M)______________。

Ⅲ.Na2S2O3的应用
(7)Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO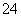 ,常用作脱氯剂,该反应的离子方程式为____________________________________________。
,常用作脱氯剂,该反应的离子方程式为____________________________________________。
(1)使硫粉易于分散到溶液中
(2)冷凝管 冷凝回流
(3)Na2SO4 取少量产品溶于过量盐酸,过滤,向滤液中加BaCl2溶液,若有白色沉淀,则产品中含有Na2SO4
(4)S2O +2H+===S↓+SO2↑+H2O
+2H+===S↓+SO2↑+H2O
(5)由无色变蓝色
(6)18.10  ×100%
×100%
(7)S2O +4Cl2+5H2O===2SO
+4Cl2+5H2O===2SO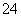 +8Cl-+10H+
+8Cl-+10H+
[解析] (1)硫粉难溶于水,微溶于乙醇,故硫粉用乙醇润湿后易扩散到溶液中。(2)装置中仪器a是冷凝管,起冷凝回流汽化的反应物的作用。(3)因反应物Na2SO3易被空气中的氧气氧化成Na2SO4,故可能存在的无机杂质是Na2SO4;检验产品中是否含有Na2SO4,即检验SO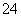 是否存在,需要防止SO
是否存在,需要防止SO 的干扰,故不能用具有强氧化性的硝酸酸化,而应用盐酸酸化,过滤除去不溶物,再向滤液中滴加氯化钡溶液。(4)产品发黄,说明产品中含有硫杂质,这是由于在酸性环境中Na2S2O3不稳定,发生歧化反应:2H++S2O
的干扰,故不能用具有强氧化性的硝酸酸化,而应用盐酸酸化,过滤除去不溶物,再向滤液中滴加氯化钡溶液。(4)产品发黄,说明产品中含有硫杂质,这是由于在酸性环境中Na2S2O3不稳定,发生歧化反应:2H++S2O ===S↓+SO2↑+H2O所致。(5)滴定终点时,过量的单质碘使无色的淀粉溶液变蓝,可指示滴定终点。(6)起始读数为0.00 mL,终点读数为18.10 mL,所以消耗碘的标准溶液的体积为18.10 mL-0.00 mL=18.10 mL;根据2Na2S2O3·5H2O~2S2O
===S↓+SO2↑+H2O所致。(5)滴定终点时,过量的单质碘使无色的淀粉溶液变蓝,可指示滴定终点。(6)起始读数为0.00 mL,终点读数为18.10 mL,所以消耗碘的标准溶液的体积为18.10 mL-0.00 mL=18.10 mL;根据2Na2S2O3·5H2O~2S2O ~I2,得n(Na2S2O3·5H2O) =2n(I2)=2×0.100 0 mol·L-1×18.10×10-3 L=3.620×10-3 mol,则产品的纯度
~I2,得n(Na2S2O3·5H2O) =2n(I2)=2×0.100 0 mol·L-1×18.10×10-3 L=3.620×10-3 mol,则产品的纯度 ×100%=
×100%= ×100%。(7)S2O
×100%。(7)S2O 被Cl2氧化成SO
被Cl2氧化成SO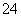 ,Cl2被还原为Cl-,首先根据化合价升降总数相等写出S2O
,Cl2被还原为Cl-,首先根据化合价升降总数相等写出S2O +4Cl2→2SO
+4Cl2→2SO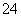 +8Cl-,然后根据原子守恒和电荷守恒写出S2O
+8Cl-,然后根据原子守恒和电荷守恒写出S2O +4Cl2+5H2O===2SO
+4Cl2+5H2O===2SO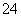 +8Cl-+10OH-。
+8Cl-+10OH-。


科目:高中化学 来源: 题型:
下列溶液中,跟100 mL 0.5 mol/L NaCl溶液中所含的Cl-物质的量浓度相同的是( )
A.100 mL 0.5 mol/L MgCl2溶液
B.200 mL 0.25 mol/L AlCl3 溶液
溶液
C.50 mL 1 mol/L NaCl溶液
D.25 mL 0.5 mol/L HCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于胶体的说法中正确的是( )
A.溶液和胶体的本质区别是当一束光线通过胶体时可出现一条光亮的通路,溶液则没有此现象
B.制备Fe(OH)3胶体的方法是将饱和氯化铁溶液加热煮沸
C.静电除尘,利用了胶体电泳
D.胶体不均一、不稳定,静置易产生沉淀;溶液均一、稳定,静置不产生沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
在宏观—微观—符号之间建立联系,是化 学学科特有的思维方式。汽车尾气是造成大气污染的主要原因之一,在汽车排气管上安装“催化转换器”便可以使汽车的尾气转换成无毒气体。如用●表示碳原子,用○表示氧原子,用
学学科特有的思维方式。汽车尾气是造成大气污染的主要原因之一,在汽车排气管上安装“催化转换器”便可以使汽车的尾气转换成无毒气体。如用●表示碳原子,用○表示氧原子,用 表示氮原子,下图为气体转换的微观过程。请你根据图示回答下列问题:
表示氮原子,下图为气体转换的微观过程。请你根据图示回答下列问题:

(1)A、B、C三种物质可以归为一类的依据是___________________________________。
(2)将C归为化合物,将D归为单质的理由是________________________________
________________________________________________________________________。
(3)用化学反应方程式表示为___________________________________________
________________________________________________________________________。
化学变化过程中消耗的A物质和生成的C物质的质量比为________。
(4)从微观的角度去描述你获得的关于化学变化的有关信息(答出一条即可)________________________________________________________________________
__________________________________________________ ______________________。
______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
能正确表示下列反应的离子反应方程式为( )
A.NH4HCO3溶于过量的浓KOH溶液中:
NH + HCO
+ HCO +2OH-=== CO
+2OH-=== CO + NH3↑+2H2O
+ NH3↑+2H2O
B.向明矾溶液中滴加Ba(OH)2溶液,恰好使SO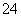 沉淀完全:2Al3++3SO
沉淀完全:2Al3++3SO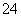 +3Ba2++
+3Ba2++
6OH-===2Al(OH)3↓+3BaSO4↓
C.向FeBr2溶液中通入足量氯气:2Fe2++4Br-+3Cl2===2Fe3++2Br2+6Cl-
D.醋酸除去水垢:2H++CaCO3===Ca2++ CO2↑+ H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
碳、硫的含量影响钢铁性能。碳、硫含量的一种测定方法是将钢样中的碳、硫转化为气体,再用测碳、测硫装置进行测定。
(1)采用装置A,在高温下将x g钢样中的碳、硫转化为CO2、SO2。

①气体a的成分是______。
②若钢样中硫以FeS形式存在,A中反应:
3FeS+5O2 1________+3________。
1________+3________。
(2)将气体a通入测硫装置中(如图),采用滴定法测定硫的含量。

①H2O2氧化SO2的化学方程式:__________________。
②用NaOH溶液滴定生成的H2SO4,消耗z mL NaOH溶液。若消耗1 mL NaOH溶液相当于硫的质量为y g,则该钢样中硫的质量分数:________。
(3)将气体a通入测碳装置中(如图),采用重量法测定碳的含量。
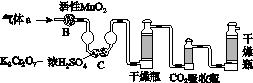
①气体a通过B和C的目的是________________________________________。
②计算钢样中碳的质量分数,应测量的数据是_______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
溴及其化合物广泛应用于医药、农药、纤维、塑料阻燃剂等,回答下列问题:
(1)海水提溴过程中,向浓缩的海水中通入________,将其中的Br-氧化,再用空气吹出溴;然后用碳酸钠溶液吸收溴,溴歧化为Br-和BrO ,其离子方程式为__________________________________________。
,其离子方程式为__________________________________________。
(2)溴与氯能以共价键结合形成BrCl。BrCl分子中,________显正电性。BrCl与水发生反应的化学方程式为____________________________________________。
(3)CuBr2分解的热化学方程式为:
2CuBr2(s)===2CuBr(s)+ Br2(g)
ΔH=+105.4 kJ/mol
在密闭容器中将过量CuBr2于487 K下加热分解,平衡时p(Br2)为4.66×103 Pa。
①如反应体系的体积不变,提高反应温度,则p(Br2)将会________(填“增大”“不变”或“减小”)。
②如反应温度不变,将反应体系的体积增加一倍,则p(Br2)的变化范围为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式不正确的是( )
A.醋酸溶液中加入少量氢氧化镁固体:Mg(OH)2+2CH3COOH===Mg2++2CH3COO-+2H2O
B.H2O2溶液中加入足量酸性KMnO4溶液:2MnO +3H2O2+6H+===2Mn2++6H2O+4O2↑
+3H2O2+6H+===2Mn2++6H2O+4O2↑
C.Ca(HCO3)2溶液中加入足量澄清石灰水:Ca2++HCO +OH-===CaCO3↓+H2O
+OH-===CaCO3↓+H2O
D.NH4HSO4的稀溶液中逐滴加入Ba(OH)2溶液至SO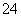 恰好沉淀完全:NH
恰好沉淀完全:NH +H++SO
+H++SO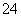 +Ba2++2OH-===NH3·H2O+BaSO4↓+H2O
+Ba2++2OH-===NH3·H2O+BaSO4↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
铁是地壳中含量第二的金属元素,其单质、合金及化合物在生产生活中的应用广泛。
(一)工业废水中含有一定量的Cr2O72−和CrO42−,它们会对人类及生态系统产生很大的危害,必须进行处理。常用的处理方法是电解法,该法用Fe作电极电解含Cr2O72−的酸性废水,随着电解的进行,阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(1)用Fe作电极的目的是_______________________________。
(2)阴极附近溶液pH升高的原因是_______________________________(用电极反应式解释);溶液中同时生成的沉淀还有________________。
(二)氮化铁磁粉是一种磁记录材料,利用氨气在400℃以上分解得到的氮原子渗透到高纯铁粉中可制备氮化铁。制备高纯铁粉涉及的主要生产流程如下:

已知:①某赤铁矿石含60.0%Fe2O3、3.6%FeO,还含有Al2O3、MnO2、CuO等。
②部分阳离子以氢氧化物形式完全沉淀时溶液的pH如下:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 6.7 |
(3)步骤②中加双氧水的目的是_________________________,pH控制在3.4的作用是_____________________________;已知25℃时,Ksp[Cu(OH)2]=2.0×10-20,该温度下反应:Cu2++2H2O Cu(OH)2+2H+的平衡常数K=_______________。
Cu(OH)2+2H+的平衡常数K=_______________。
(4)制备氮化铁的反应:Fe+NH3 FexNy+H2(未配平),若整个过程中消耗氨气34.0g,消耗赤铁矿石2kg,设整个过程中无损耗,则FexNy磁粉的化学式为___________。
FexNy+H2(未配平),若整个过程中消耗氨气34.0g,消耗赤铁矿石2kg,设整个过程中无损耗,则FexNy磁粉的化学式为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com