
| A. | 一定存在Ag+ | B. | 一定存在CO32- | C. | 一定存在SO42- | D. | 以上说法都不对 |
分析 将BaCl2溶液加入某无色溶液后,生成白色沉淀,再加入稀HNO3,则沉淀不溶解,该沉淀可能为硫酸钡或氯化银,原溶液中可能含有Ag+、SO42-、SO32-,据此进行解答.
解答 解:BaCl2溶液加入某无色溶液后,生成白色沉淀,再加入稀HNO3,则沉淀不溶解,稀硝酸具有强氧化性,则该沉淀可能为硫酸钡或氯化银,原溶液中可能含有Ag+、SO42-、SO32-,
根据分析可知,原溶液中不一定含有Ag+或SO42-,一定不存在CO32-,
故选D.
点评 本题考查了常见离子的检验方法,题目难度不大,明确常见离子的性质为解答关键,注意掌握常见离子的检验方法,试题培养了学生的灵活应用能力.


 互动英语系列答案
互动英语系列答案科目:高中化学 来源: 题型:选择题
| A. | 2.0×10-6mol/L | B. | 3.2×10-6mol/L | C. | 2.0×10-9mol/L | D. | 3.2×10-9mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤⑥⑦ | B. | ①③④⑤ | C. | ②④⑤ | D. | ①②⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
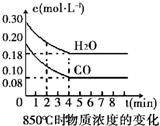
| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | C1 | C2 | C3 | C3 |
| 4 | C1 | C2 | C3 | C3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为了使火腿肠颜色更鲜红,可多加一些亚硝酸钠 | |
| B. | 为了使婴儿对食品有浓厚兴趣,我们可以在婴儿食品中加少量着色剂 | |
| C. | 服用阿斯匹林后出现胃肠道反应是中毒的表现,应立即停药 | |
| D. | 为保证人体所需足够蛋白质我们要多吃肉,少吃蔬菜和水果 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
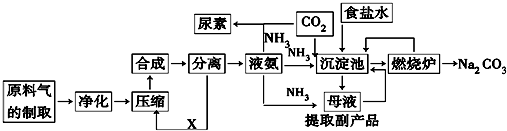
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com