
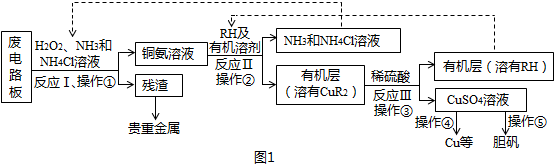
分析 废电路板中加入双氧水、氨气、氯化铵溶液,得到铜氨溶液和残渣,分离难溶性固体和溶液采用过滤方法,所以操作①是过滤,反应Ⅰ是将Cu转化为Cu(NH3)42+,Cu元素化合价由0价变为+2价,所以Cu是还原剂,则双氧水是氧化剂,将Cu氧化;反应Ⅱ是铜氨溶液中的Cu(NH3)42+与有机物RH反应,生成CuR2,同时生成NH4+和NH3;
互不相溶的液体采用分液方法分离,所以操作②是分液;向有机层中加入稀硫酸,根据流程图知,生成CuSO4和HR,然后采用分液方法分离得到HR,以石墨为电极电解硫酸铜溶液时,阳极上氢氧根离子放电、阴极上铜离子放电;从硫酸铜溶液中获取胆矾,采用加热浓缩、冷却结晶、过滤的方法得到晶体;
(1)双氧水具有氧化性,能氧化还原性物质,分离难溶性固体和溶液采用过滤方法;
(2)反应Ⅱ是铜氨溶液中的Cu(NH3)42+与有机物RH反应生成CuR2,同时生成NH4+和NH3,根据反应物和生成物书写该反应的离子方程式为;分离互不相溶的液体采用分液方法,分液时常用分液漏斗;
(3)反应Ⅲ是有机溶液中的CuR2与稀硫酸反应生成CuSO4和RH,分液时分液漏斗下端要紧靠烧杯内壁,且分液漏斗内不能盛放太多溶液;
(4)以石墨为电极电解硫酸铜溶液时,阳极上氢氧根离子放电、阴极上铜离子放电,SO42-向阳极移动;从溶液中获取晶体采用加热浓缩、冷却结晶、过滤方法;
(5)电解硫酸铜溶液时能得到硫酸,硫酸能循环利用;氯化铵电离出的铵根离子抑制一水合氨电离而降低溶液碱性.
解答 解:废电路板中加入双氧水、氨气、氯化铵溶液,得到铜氨溶液和残渣,分离难溶性固体和溶液采用过滤方法,所以操作①是过滤,反应Ⅰ是将Cu转化为Cu(NH3)42+,Cu元素化合价由0价变为+2价,所以Cu是还原剂,则双氧水是氧化剂,将Cu氧化;反应Ⅱ是铜氨溶液中的Cu(NH3)42+与有机物RH反应,生成CuR2,同时生成NH4+和NH3;
互不相溶的液体采用分液方法分离,所以操作②是分液;向有机层中加入稀硫酸,根据流程图知,生成CuSO4和HR,然后采用分液方法分离得到HR,以石墨为电极电解硫酸铜溶液时,阳极上氢氧根离子放电、阴极上铜离子放电;从硫酸铜溶液中获取胆矾,采用加热浓缩、冷却结晶、过滤的方法得到晶体;
(1)双氧水具有氧化性,能氧化还原性物质Cu,所以双氧水作氧化剂;分离难溶性固体和溶液采用过滤方法,该混合溶液中贵重金属是难溶物、铜氨溶液是液体,所以操作①是过滤,故答案为:氧化剂;过滤;
(2)反应Ⅱ是铜氨溶液中的Cu(NH3)42+与有机物RH反应生成CuR2,同时生成NH4+和NH3,根据反应物和生成物书写该反应的离子方程式Cu(NH3)42++2RH=CuR2+2NH4++2NH3↑;分离互不相溶的液体采用分液方法,分液时常用分液漏斗,分液的目的是富集铜元素、使铜元素与水溶液中的物质分离,所以ab正确,
故答案为:Cu(NH3)42++2RH=CuR2+2NH4++2NH3↑;分液漏斗;ab;
(3)反应Ⅲ是有机溶液中的CuR2与稀硫酸反应相当于复分解反应,所以生成CuSO4和RH,分液时分液漏斗下端要紧靠烧杯内壁,且分液漏斗内不能盛放太多溶液,
故答案为:RH;分液漏斗尖端未紧靠烧杯内壁;液体过多;
(4)以石墨为电极电解硫酸铜溶液时,阳极上氢氧根离子放电、阴极上铜离子放电,所以阳极上生成O2,同时有大量的H+生成,且SO42-也向阳极移动在阳极积累,因此阳极产物还有H2SO4;从溶液中获取晶体采用加热浓缩、冷却结晶、过滤方法,
故答案为:O2、H2SO4;加热浓缩、冷却结晶、过滤;
(5)电解硫酸铜溶液时能得到硫酸,在反应III中用到硫酸,所以H2SO4能循环利用;氯化铵电离出的铵根离子抑制一水合氨电离而降低溶液碱性,从而抑制氢氧化铜生成,
故答案为:H2SO4;防止由于溶液中c(OH-)过高,生成Cu(OH)2沉淀.
点评 本题为2015年高考题,考查物质分离和提纯,涉及基本实验操作、氧化还原反应、电解原理等知识点,侧重考查学生实验操作规范性、知识综合应用能力等,能从整体上把握是解本题关键,易错点是(5)题第一个空,题目难度中等.


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:选择题
| A. | 分子式符合CnH2n+2的烃一定是烷烃 | |
| B. | 烷烃均能与氯水发生取代反应 | |
| C. | 辛烷的熔沸点比壬烷低 | |
| D. | 烷烃不能被酸性高锰酸钾等强氧化剂氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
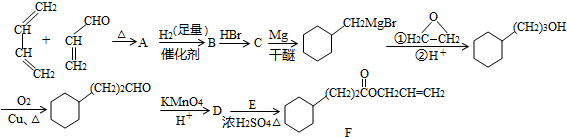
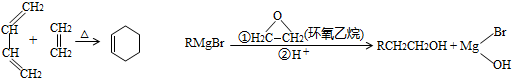
 ,A中所含官能团的名称是醛基、碳碳双键.
,A中所含官能团的名称是醛基、碳碳双键. .
.  .
.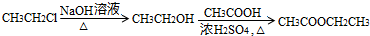
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

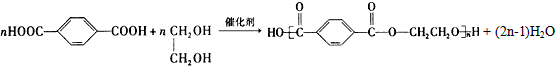 .
.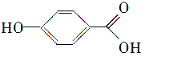 .
.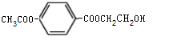 、
、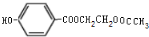 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na与H2O的反应是熵增的放热反应,该反应能自发进行 | |
| B. | 饱和Na2SO4溶液或浓硝酸均可使蛋白质溶液产生沉淀,但原理不同 | |
| C. | FeCl3和MnO2均可加快H2O2分解,同等条件下二者对H2O2分解速率的改变相同 | |
| D. | Mg(OH)2固体在溶液存在平衡:Mg(OH)2(s)?Mg2+(aq)+2OH-(aq),该固体可溶于NH4Cl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素C的单质只存在金刚石和石墨两种同素异形体 | |
| B. | Mg、MgO中镁元素微粒的半径:r(Mg2+)>r(Mg) | |
| C. | 在该反应条件下,Mg的还原性强于C的还原性 | |
| D. | 该反应中化学能全部转化为热能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若H2O2分解产生1molO2,理论上转移的电子数约为4×6.02×1023 | |
| B. | 室温下,pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合,溶液pH>7 | |
| C. | 钢铁水闸可用牺牲阳极或外加电流的阴极保护法防止其腐蚀 | |
| D. | 一定条件下反应N2+3H2?2NH3达到平衡时,3v正(H2)=2v逆(NH3) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 阶段/含量%/成分 | Y2O3 | ZnO | Al2O3 | PbO2 | MgO |
| 预处理前 | 24.28 | 41.82 | 7.81 | 1.67 | 0.19 |
| 预处理后 | 68.51 | 5.42 | 4.33 | 5.43 | 0.50 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  用装置精炼铜,则b极为精铜,电解质溶液为CuSO4溶液 | |
| B. |  装置的总反应是Cu+2Fe3+=Cu2++2Fe2+ | |
| C. |  装置中钢闸门应与外接电源的负极相连 | |
| D. |  装置中的铁钉浸入浓硫酸中几乎没被腐蚀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com