
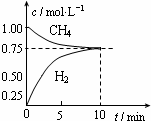
 工业上制备合成气的工艺主要是水蒸气重整甲烷:CH4(g)+H2O(g)?CO(g)+3H2(g);△H=+206kJ/mol,一定条件下向体积为1L的密闭容器中充入1mol CH4和1mol H2O,测得CH4(g)和CO(g)的浓度随时间变化曲线如图所示,下列说法正确的是( )
工业上制备合成气的工艺主要是水蒸气重整甲烷:CH4(g)+H2O(g)?CO(g)+3H2(g);△H=+206kJ/mol,一定条件下向体积为1L的密闭容器中充入1mol CH4和1mol H2O,测得CH4(g)和CO(g)的浓度随时间变化曲线如图所示,下列说法正确的是( )| A. | 10min时用CH4表示的反应速率为0.075 mol•L-1•min-1 | |
| B. | 使用高效催化剂能够增大CO的产率 | |
| C. | 该条件下反应的平衡常数为0.1875 | |
| D. | 升高温度能使$\frac{c(C{H}_{4})}{c(CO)}$增大 |
分析 A.0~10min时CH4的浓度减少1mol/L-0.75mol/L=0.25mol/L,结合v=$\frac{△c}{△t}$计算;
B.催化剂对平衡移动无影响;
C.结合图及反应CH4(g)+H2O(g)?CO(g)+3H2(g)
开始 1 1 0 0
转化 0.25 0.25 0.25 0.75
平衡 0.75 0.75 0.25 0.75
K为生成物浓度幂之积与反应物浓度幂之积的比,结合平衡浓度计算K;
D.△H>0,为吸热反应,升高温度,平衡正向移动.
解答 解:A.0~10min时CH4的浓度减少1mol/L-0.75mol/L=0.25mol/L,10min内用CH4表示的反应速率为v=$\frac{△c}{△t}$=$\frac{0.25mol/L}{10min}$=0.025 mol•L-1•min-1,故A错误;
B.催化剂对平衡移动无影响,则使用高效催化剂,CO的产率不变,故B错误;
C.结合图及反应CH4(g)+H2O(g)?CO(g)+3H2(g)
开始 1 1 0 0
转化 0.25 0.25 0.25 0.75
平衡 0.75 0.75 0.25 0.75
K为生成物浓度幂之积与反应物浓度幂之积的比,K=$\frac{0.25×0.7{5}^{3}}{0.75×0.75}$=0.1875,故C正确;
D.△H>0,为吸热反应,升高温度,平衡正向移动,能使$\frac{c(C{H}_{4})}{c(CO)}$减小,故D错误;
故选C.
点评 本题考查化学平衡的计算,为高频考点,把握化学平衡三段法、转化率和速率计算等为解答的关键,侧重分析与计算能力的考查,注意平衡移动的影响因素,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
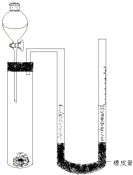 在化学研究领域,经常需要对一些物质进行性质的确定.如利用下列装置(夹持仪器已略去)测出一定质量镁与盐酸反应放出的气体体积,对金属镁的相对原子质量进行测定,实验步骤如下:
在化学研究领域,经常需要对一些物质进行性质的确定.如利用下列装置(夹持仪器已略去)测出一定质量镁与盐酸反应放出的气体体积,对金属镁的相对原子质量进行测定,实验步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 前20 min的平均反应速度$\overline v$(C)=0.1 mol/(L•min) | |
| B. | A的转化率为50% | |
| C. | C的平衡浓度c(C)=4 mol/L | |
| D. | B的平衡浓度c(B)=1.0 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | E2F2 | B. | E2F3 | C. | EF3 | D. | EF2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,相同体积的SO2和SO3,质量比为4:5 | |
| B. | 相同状况下,质量相同的O2和O3,密度之比为3:2 | |
| C. | 相同质量的金刚石和石墨含有相同的C原子数和共价键数 | |
| D. | 标准状况下,相同体积的C2H2和C2H4,密度比为13:14 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com