
A~F均为元素周期表中前四周期元素,其相关信息如下表:
| 元素 | 相 关 信 息 |
| A | A的基态原子最外层电子排布式为2s22p3 |
| B | B是地壳中含量最高的元素 |
| C | C+与B的简单离子的电子层结构相同 |
| D | D的一种核素的质量数为64,中子数为35 |
| E 、F | E 、F既同周期又同族,且原子序数F比E多2 |
科目:高中化学 来源: 题型:填空题
(12分)【化学——物质结构与性质】
铜单质及其化合物在很多领域有重要用途,如金属铜用来制造电线电缆,无水合硫酸铜可用作杀菌剂等。
(1)Cu2+的核外电子排布式为________________。
(2)科学家通过X射线测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如下: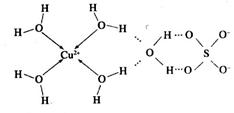
①胆矾的化学式用配合物的形式表示为______。
②胆矾中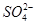 的空间构型为_________,H2O中O原子的杂化方式为____________。
的空间构型为_________,H2O中O原子的杂化方式为____________。
(3)向硫酸铜溶液中加入过量氨水,可生成 配离子。已知
配离子。已知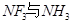 的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是____________________________。
的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是____________________________。
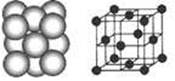
(4)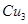 N形成的晶体结构如图所示,N3-的配位数是________。设晶胞边长为a cm,密度为b g/cm3,则阿伏加德罗常数可表示为___________(用含a、b的式子表示)。
N形成的晶体结构如图所示,N3-的配位数是________。设晶胞边长为a cm,密度为b g/cm3,则阿伏加德罗常数可表示为___________(用含a、b的式子表示)。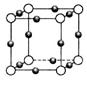
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(12分)甲同学拟通过实验探究同主族元素性质的递变规律,以及影响化学反应速率的因素。其设计的实验方案如下,请你帮他填写完整,并做出评价。
实验室提供的试剂:锌块、锌粉、铁条、铁粉、铜条、NaBr溶液、NaI溶液、新制的氯水、1mol/L盐酸、3mol/L的盐酸
(1)探究同主族元素性质的递变规律
①写出下列实验报告中的实验现象和离子方程式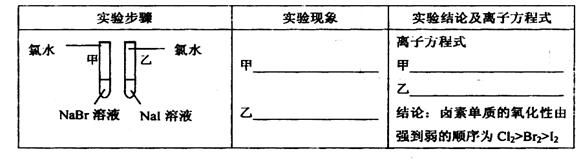
②【评价】甲同学设计的实验方案的合理性是___________(填序号)
A. 非常合理 B. 部分合理 C. 完全不合理
③【补充和完善】上一题②中若选A,则此项不用再作答,若选B或C,则完成实验还需要的试剂是___________。
(2)探究影响化学反应速率的因素
| 实验步骤 | 实验现象 | 实验依据和结论 |
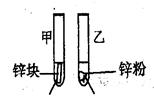 3mL1mol/L 3mL3mol/L 盐酸 盐酸 (金属质量相同,盐酸均过量) | 均有气体生成,锌粉先消失,锌块后消失 | 因为乙试管中的反应更快,所以反应物浓度越大,反应速率越快。 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下表中列出五种短周期元素A、B、C、D、E的信息,请推断后回答:
| 元素 | 有 关 信 息 |
| A | 元素主要化合价为-2,原子半径为0.074 nm |
| B | 所在主族序数与所在周期序数之差为4 |
| C | 原子半径为0.102 nm,其单质为黄色晶体,可在A的单质中燃烧 |
| D | 最高价氧化物的水化物能按1︰1电离出电子数相等的阴、阳离子 |
| E | 原子半径为0.075 nm,最高价氧化物的水化物可与其氢化物形成一种盐X |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
元素的性质在元素周期表中按其排列呈现一定的规律。下表为元素周期表中部分元素,根据要求回答下列问题:
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge |
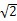 ”的式子表示,不必算结果)
”的式子表示,不必算结果)查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D、E、F六种元素,其中A、B、C、D、E为短周期主族元素。它们之间的关系如下:
(Ⅰ)原子半径:A < C < B < E < D
(Ⅱ)原子的最外层电子数:A = D, C = E, A+B = C。
(Ⅲ)原子的核外电子层数:B = C = 2A
(Ⅳ)B元素的主要化合价:最高正价+最低负价 = 2
(Ⅴ)F的单质或合金是用量最大的金属材料。
请回答:(1)甲由A、B两种元素按原子数之比为3:1组成的物质,写出其电子式 ;
(2)写出某含F黑色的磁性氧化物与B最高价氧化物对应水化物的稀溶液反应的离子方程式: 。
(3)由A、C、E三种元素组成的两种气体化合物,相互反应能生成淡黄色固体的化学反应方程式为: 。
(4)上述元素中A、B、C、E、F的五种元素可形成一种常见复盐,经检测该复盐由三种离子组成且离子个数比为1:1:2,向该盐溶液加入酸化的BaCl2溶液,产生白色沉淀;加入NaOH溶液并加热,产生能使湿润红色石蕊试纸变蓝的气体,则该复盐的化学式为 。为检验该复盐中的某种有色离子存在,请写出实验的操作步骤和现象 ;
(5)将上述复盐配成0.1L 0.1mol/L的溶液,向其中加入0.06mol的BaCl2固体完全反应后,该溶液中c(SO42-)为: (已知:忽略溶液体积变化。该沉淀的Ksp=2×10-9)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下表是元素周期表的一部分,回答下列有关问题: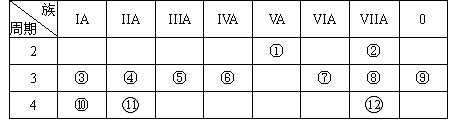
(1)写出下列元素符号:① ,⑥ ,⑦ 。
(2)画出原子的结构示意图:④ ,⑤ ,⑧ 。
(3)在这些元素中,最活泼的金属元素是 ,最活泼的非金属元素是 ,最不活泼的元素是 。(均填元素符号)
(4)在这些元素的最高价氧化物对应水化物中,酸性最强的是 ,碱性最强的是 ,呈两性的氢氧化物是 。
(5)在③与④中,化学性质较活泼的是 (填元素符号),怎样用化学实验证明:
答: (该空2分,其余每空1分)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
V、W、X、Y、Z是原子序数依次递减的五种常见元素。X元素是地壳中含量最多的元素,Y、Z组成的气态化合物M的水溶液呈碱性,W的单质在X2中燃烧产物可使品红溶液褪色,V是一种历史悠久、应用广泛的金属元素。请回答:
(1)Y元素在周期表中的位置是 ;写出X、Z两种元素组成的化合物Z2X2的一种用途: 。
(2)由以上五种元素两两组合所形成的化合物中,有一种物质能与水反应生成气体且反应属于氧化还原反应,请写出该反应的化学方程式 。
(3)X、Y、Z三种元素可组成一种强酸U,M在适当条件下被U吸收生成一种盐。该盐的水溶液的pH 7(填“大于”、“小于”或“等于”)。原因是(用离子方程式表示)
(4)若将V金属投入到盐酸中,生成了浅绿色溶液N。N的酸性溶液与双氧水反应的离子方程式:
(5)有人设想寻求合适的催化剂和电极材料,以Y2、Z2为电极反应物,以HCl—NH4Cl溶液为电解质溶液制造新型燃料电池,试写出该电池的正极电极反应式 ;放电时溶液中H+移向 (填“正”或“负”)极。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
Q、W、X、Y、Z为5种短周期元素,且原子序数依次增大。W、X与Y同周期,Y与Z同主族。Q与W可以按照原子个数比4:1形成化合物甲,且甲分子中含有10个电子。Q与X形成化合物乙,乙可与Z的最高价氧化物的水化物按照物质的量之比2:1反应形成盐丙。
(1)甲的电子式是 。
(2)Q和Y形成的既含极性键又含非极性键的共价化合物的化学式是 。
(3)向少量丙溶液中加入浓Ba(OH)2溶液至过量并加热,反应的离子方程式是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com