
【题目】某化学课外兴趣小组为探究铜与浓硫酸反应气体产物的性质,拟用如图所示的装置的组合进行实验. 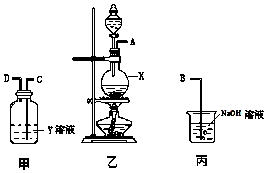
请回答下列问题:
(1)仪器X的名称为 .
(2)Y溶液可以是 , 相应的实验现象是 .
(3)丙装置的作用是 . 写出丙装置中反应方程式
(4)写出铜与浓硫酸反应方程式 .
【答案】
(1)圆底烧瓶
(2)品红溶液;溶液红色褪去
(3)除去二氧化硫尾气,避免污染空气;2NaOH+SO2=Na2SO3+H2O
(4)Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
【解析】解:(1)由图可知,仪器X的名称为圆底烧瓶,所以答案是:圆底烧瓶;(2)若甲探究二氧化硫的漂白性,Y溶液可以是品红溶液,相应的实验现象是溶液红色褪去(若探究二氧化硫的还原性,Y为酸性KMnO4溶液,观察到紫色褪去等),所以答案是:品红溶液;溶液红色褪去;(3)二氧化硫有毒,不能排放在环境中,则丙装置的作用是除去二氧化硫尾气,避免污染空气,反应的化学方程式为:2NaOH+SO2=Na2SO3+H2O,所以答案是:除去二氧化硫尾气,避免污染空气;2NaOH+SO2=Na2SO3+H2O;(4)铜与浓硫酸反应生成硫酸铜、二氧化硫气体和水,反应的化学方程式为:Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O,所以答案是:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O,所以答案是:Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O.
CuSO4+SO2↑+2H2O.


科目:高中化学 来源: 题型:
【题目】锂-液态多硫电池具有能量密度高、储能成本低等优点,以熔融金属银、熔融硫和多硫化锂分别作两个电极的反应物,固体Al2O3陶瓷(可传导Li+)为电解质,其反应原理如图所示。下列关于其说法错误的是
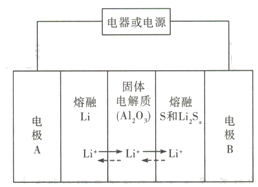
A. 放电时,电极B为正极
B. 充电时内电路中Li+的移动方向为从B到A
C. 该电池的适宜工作温度应该在Al2O3的熔点和沸点之间
D. 充电时,阳极反应为Sx2--2e-=xS
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于元素性质对比正确的是
A. 金属性:K>Na>Cs B. 稳定性:SiH4>H2S>HCl
C. 酸性:H2CO3>H2SiO3>HClO4 D. 非金属性:Cl>S>P
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一体积可变的密闭容器中,加入一定量的X、Y,发生反应mX(g)![]() nY(g) ΔH=Q kJ/mol。反应达到平衡时,Y的物质的量浓度与温度、气体体积(容器容积)的关系如下表所示:
nY(g) ΔH=Q kJ/mol。反应达到平衡时,Y的物质的量浓度与温度、气体体积(容器容积)的关系如下表所示:
气体体积/L | 1 | 2 | 3 |
100 | 1.00 | 0.75 | 0.53 |
200 | 1.20 | 0.90 | 0.63 |
300 | 1.30 | 1.00 | 0.70 |
下列说法正确的是
A.m>n
B.Q<0
C.温度不变,压强增大,Y的质量分数减少
D.体积不变,温度升高,平衡向逆反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《中华人民共和国大气污染防治法》于2016年1月1日起实施。为保护和改善大气环境,下列做法不应该提倡的是
A. 开发生物质能替代化石燃料 B. 向高空排放金属冶炼产生的粉尘
C. 用催化转化技术处理汽车尾气 D. 大力推广生产和使用无氟冰箱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列各问题:
(1)①泡沫灭火器中的药品为NaHCO3和Al2(SO4)3,其反应的离子方程式为:__________;
②TiCl4水解生成TiO2·xH2O的化学方程式__________;
③酸性高锰酸钾溶液与草酸溶液反应的化学方程式____________;
④硫代硫酸钠溶液与稀硫酸反应的化学万式____________;
(2)碳酸氢钠溶液中的粒子物质的量浓度有多种关系,请分别写出
①电荷数守恒_________;
②物料守恒___________;
③质子守恒___________;
④下列粒子浓度由大到小的顺序为c(Na+)、c(HCO3-)、c(CO32-),c(H2CO3)、c(OH-)_________。
(3)常温下,取20mL某浓度的HCl作为待测液,用一定物质的量浓度的NaOH溶液进行滴定(假设盐酸与NaOH溶液混合后体积变化忽略不计),滴定过程中溶液的pH变化如右图所示。所用NaOH溶液浓度为____________。
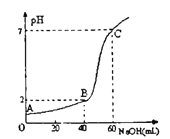
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙烯可以通过下列方法合成:
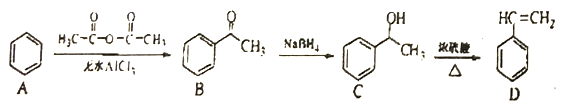
(1)A![]() B的反应的反应类型是_______;该反应还会生成另一种有机物,其结构简式为____。
B的反应的反应类型是_______;该反应还会生成另一种有机物,其结构简式为____。
(2)C中含氧官能团的名称是________;C物质能与CH3COOH在浓硫酸作用下,发生酯化反应,写出相应化学反应方程式_______
(3)检验产物D中溶有C的实验方法是______。
(4)B有多种同分异构体:E是B的芳香类同分异构体,结构上满足下列条件。则E的结构简式为_________。
A.能发生银镜反应 B.且苯环上的一氯代物只有2种
(5)对羧基聚苯乙烯(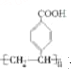 )是合成功能高分子材料的重要中间体。
)是合成功能高分子材料的重要中间体。
己知:①NaBH4为选择性还原剂,不能还原羧酸
②苯甲酸发生苯环取代时,生成间位产物.
试写出以甲苯等为主要原料,合成对羧基聚苯乙烯的流程图(无机试剂任选)合成路线流程图示例如下:![]() _____________________
_____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】BaCl2xH2O是用途广泛的基础化工产品。我国目前主要是用盐酸和硫化钡(含少量Mg2+、Fe3+等)反应生产BaCl2xH2O,工艺流程如下图所示。
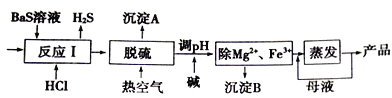
已知: 室温时Ksp[Mg(OH)2]= 1.8×10-11,Ksp[Fe(OH)3]=4.0×10-38,请回答下列问题:
(1)写出氯化钡的电子式______,盐酸和硫化钡反应的化学方程式为___________。
(2)反应I中生成的H2S用足量氨水吸收,一定条件下向所得溶液中通入空气,可得到单质硫并使吸收液再生,吸收液再生反应的化学方程式为_______________________。
(3)沉淀A的成分是__________。
(4)热空气吹除时会有部分HS-转变为S2O32-,使产品仍达不到纯度要求,可再进行酸化脱硫,酸化脱硫时的离子方程式为________________。
(5)室温时,若加碱调溶液pH至9,则完全沉淀的离子是_____________(写出计算过程)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com