
【题目】能正确表示下列反应的离子方程式是
A. 向次氯酸钙溶液通入过量CO2:Ca2++2ClO—+CO2+H2O =CaCO3↓+2HClO
B. 向次氯酸钙溶液通入SO2:Ca2++2ClO—+SO2+H2O= CaSO3↓+2HClO
C. 氢氧化钙溶液与碳酸氢镁溶液反应:HCO3—+Ca2++OH—=CaCO3↓+H2O
D. 在氯化亚铁溶液中加入稀硝酸:3Fe2++4H++NO3—=3Fe3++NO↑+2H2O
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】H2C2O4为二元弱酸。20℃时,配制一组c(H2C2O4)+ c(HC2O4–)+ c(C2O42–)=0.100 mol·L–1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示。下列指定溶液中微粒的物质的量浓度关系一定正确的是

A.pH=2.5的溶液中:c(H2C2O4)+c(C2O42–)>c(HC2O4–)
B.c(Na+)=0.100 mol·L–1的溶液中:c(H+)+c(H2C2O4)=c(OH–)+c(C2O42–)
C.c(HC2O4–)=c(C2O42–)的溶液中:c(Na+)>0.100 mol·L–1+c(HC2O4–)
D.pH=7的溶液中:c(Na+)>2c(C2O42–)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙微溶于水,溶于酸,可作分析试剂、医用防腐剂、消毒剂。以下是一种制备过氧化钙的实验方法。回答下列问题:
(一)碳酸钙的制备
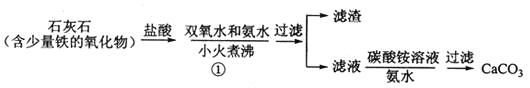
(1)步骤①加入氨水的目的是_______。小火煮沸的作用是使沉淀颗粒长大,有利于____。
(2)下图是某学生的过滤操作示意图,其操作不规范的是______(填标号)。
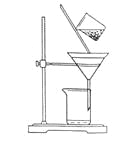
a.漏斗末端颈尖未紧靠烧杯壁
b.玻璃棒用作引流
c.将滤纸湿润,使其紧贴漏斗壁
d.滤纸边缘高出漏斗
e.用玻璃棒在漏斗中轻轻搅动以加快过滤速度
(二)过氧化钙的制备

(3)步骤②的具体操作为逐滴加入稀盐酸,至溶液中尚存有少量固体,此时溶液呈____性(填“酸”、“碱”或“中”)。将溶液煮沸,趁热过滤。将溶液煮沸的作用是___________。
(4)步骤③中反应的化学方程式为________,该反应需要在冰浴下进行,原因是_________。
(5)将过滤得到的白色结晶依次使用蒸馏水、乙醇洗涤,使用乙醇洗涤的目的是_______。
(6)制备过氧化钙的另一种方法是:将石灰石煅烧后,直接加入双氧水反应,过滤后可得到过氧化钙产品。该工艺方法的优点是______,产品的缺点是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为验证元素周期表中元素性质的递变规律,利用右图装置可验证同主族非金属性的变化规律。设计了如下系列实验。
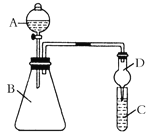
(1)向Na2S溶液中通入氯气出现淡黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为____________________________________________。
(2)仪器A的名称为____________________,
(3)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4, (KMnO4 与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到混合溶液 的现象,即可证明。从环境保护的观点考虑,此装置缺少尾气处理装置,可用______________溶液吸收尾气。
(4)若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3,C中加Na2SiO3 溶液观察到C中溶液_____________的现象,即可证明。但有的同学认为盐酸具有挥发性,应用__________溶液除去。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应![]() 在2L的密闭容器中进行,30s后NO的物质的量增加了0.30mol。下列说法正确的是( )
在2L的密闭容器中进行,30s后NO的物质的量增加了0.30mol。下列说法正确的是( )
A.容器中NH3的物质的量一定增加了0.30mol
B.容器中H2O(g)的物质的量至少为0.45mol
C.NH3的平均反应速率为0.010mol/(L·s)
D.NH3、O2、NO、H2O的物质的量之比一定为4:5:4:6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2016届怀化一模】燃料的使用和防污染是社会发展中一个无法回避的矛盾话题。
(1)直接排放煤燃烧产生的烟气会引起严重的环境问题。煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。
已知:①CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) ΔH1=-860.0 kJ·mol-1
②2NO2(g)![]() N2O4(g) ΔH2=-66.9 kJ·mol-1
N2O4(g) ΔH2=-66.9 kJ·mol-1
写出CH4催化还原N2O4(g)生成N2和H2O(g)、CO2的热化学方程式:___________________。
(2)如将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。如下图是通过人工光合作用,以CO2和H2O为原料制备HCOOH和O2的原理示意图。
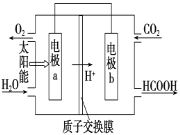
电极a、b表面发生电极反应。其中a极为:_______极,b其电极反应式为: _________________。
(3)如果用100ml 1.5mol/L的NaOH溶液吸收2.24L(标准状况)的二氧化碳气体所得溶液中各离子浓度由大到小的顺序为__________________(用离子浓度符号表示)。
(4)燃料除硫中可用到CaCO3,它是一种难溶物质,其Ksp=2.8×10—9。
①)石灰石-石膏湿法烟气脱硫工艺技术的工作原理是烟气中的二氧化硫与浆液中的碳酸钙及鼓入的空气反应生成石膏(CaSO4·2H2O)。写出该反应的化学方程式:_____________。
②有一纯碱溶液的浓度为2×10—4mo1/L,现将其与等体积的CaCl2溶液混合,则生成沉淀所需CaCl2溶液的最小浓度为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[实验化学]
焦亚硫酸钠(Na2S2O5)是常用的抗氧化剂,在空气中、受热时均易分解。实验室制备少量Na2S2O5的方法:在不断搅拌下,控制反应温度在40℃左右,向Na2CO3过饱和溶液中通入SO2,实验装置如下图所示。
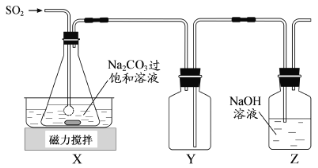
当溶液pH约为4时,停止反应,在20℃左右静置结晶。生成Na2S2O5的化学方程式为
2NaHSO3===Na2S2O5+H2O
(1)SO2与Na2CO3溶液反应生成NaHSO3和CO2,其离子方程式为____________________。
(2)装置Y的作用是______________________________。
(3)析出固体的反应液经减压抽滤、洗涤、25℃~30℃干燥,可获得Na2S2O5固体。
①组成减压抽滤装置的主要仪器是布氏漏斗、________________和抽气泵。
②依次用饱和SO2水溶液、无水乙醇洗涤Na2S2O5固体。用饱和SO2水溶液洗涤的目的是______。
(4)实验制得的Na2S2O5固体中含有一定量的Na2SO3和Na2SO4,其可能的原因是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石墨在材料领域有重要应用。某初级石墨中含SiO2(7.8%)、Al2O3(5.1%)、Fe2O3(3.1%)和MgO(0.5%)等杂质。设计的提纯与综合利用工艺如下:
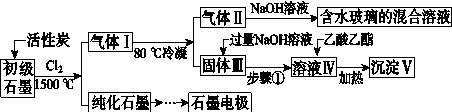
(注:SiCl4的沸点为57.6 ℃,金属氯化物的沸点均高于150 ℃)
(1)向反应器中通入Cl2前,需通一段时间N2,主要目的是 。
(2)高温反应后,石墨中氧化物杂质均转变为相应的氯化物。气体Ⅰ中的碳氧化物主要为 。由气体Ⅱ中某物得到水玻璃的化学反应方程式为 。
(3)步骤①为:搅拌、 。所得溶液Ⅳ中的阴离子有 。
(4)由溶液Ⅳ生成沉淀Ⅴ的总反应的离子方程式为 ,
100kg初级石墨最多可能获得Ⅴ的质量为 kg。
(5)石墨可用于自然水体中铜件的电化学防腐,完成如图防腐示意图,并作相应标注。
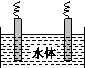
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com